Warna Nyala Logam Alkali
Warna nyala yang dihasilkan oleh suatu unsur disebut sprektum emisi. Spektrum emisi yang dihasilkan berkaitan dengan model atom Neils Bohr. Ketika atom diberikan sejumlah energi, elektron-elektron yang berada pada keadaan dasar akan tereksitasi menuju kulit yang lebih tinggi dengan ringkat energi yang lebih tinggi. Elektron yang tereksitasi dapat kembali keadaan dasar atau mengimisi dengan memancarkan sejumlah energi dalam bentuk radiasi elektromagnetik dengan panjang gelombang (λ) tertentu. Spektrum emisi terjadi ketika larutan garamnya dibakar menggunakan nyala bunsen. Spektrum emisi yang dihasilkan setiap unsur berbeda antara yang satu dengan yang lainnya.

- Gambar spektrum emisi sesium
Ketika dibakar litium menghasilkan warna merah, natrium menghasilkan warna kuning, kalium menghasilkan warna pink atau lilac, rubidium menghasilkan warna merah lembayung dan sesium menghasilkan warna merah lembayung. Warna-warna yang dihasilkan oleh unsur-unsur alkali sangat indah sehingga logam-logam alkali banyak dimanfaatkan dalam pembuatan kembang api atau mercun.
Energi Ionisasi
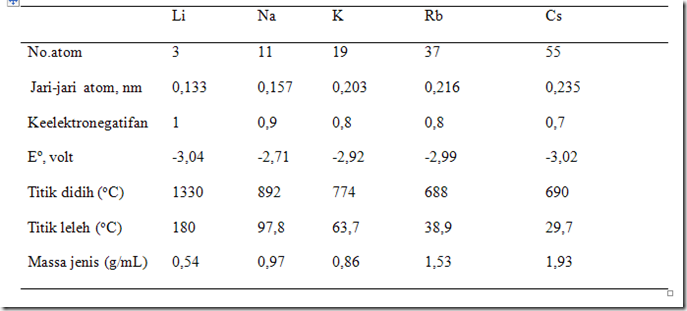
Energi ionisasi untuk unsur-unsur segolongan berhubungan erat dengan jari-jari atom. Jari-jari atom pada golongan alkali dari Li ke Cs jari-jarinya semakin besar, sesuai dengan pertambahan jumlah kulitnya. Semakin banyak jumlah kulitnya, maka semakin besar jari-jari atomnya. Semakin besar jari-jari atom, maka gaya tarik inti terhadap elektron yang terletak pada kulit terluar semakin kecil. Gaya tarik yang makin lemah menyebabkan unsur-unsur segolongan, dari atas ke bawah energi ionisasinya semakin kecil. Dengan melepas satu elektron pada kulit terluar, Li menjadi Li+, Na menjadi Na+, K manjadi K+ dan yang lainnya.
Sifat Kimia
Logam alkali merupakan unsur logam yang sangat reaktif dibanding logam golongan lain. Hal ini disebabkan pada kulit terluarnya hanya terdapat satu elektron dan energi ionisasi yang lebih kecil dibanding unsur golongan lain. Dalam satu golongan, dari atas ke bawah, kereaktifan logam alkali makin bertambah seirng bertambahnya nomor atom.
Reaksi dengan Air
Produk yang diperoleh dari reaksi antara logam alkali dan air adalah gas hidrogen dan logam hidroksida. Logam hidroksida yang dihasilkan merupakan suatu basa kuat. Makin kuat sifat logamnya basa yang dihasilkan makin kuat pula, dengan demikian basa paling kuat yaitu dihasilkan oleh sesium. Reaksi antara logam alkali dan air adalah sebaga berikut:
2M(s) + 2H2O(l) ―→ 2MOH(aq) + H2(g) (M = logam alkali)
Reaksi antara logam alkali dengan air merupakan reaksi yang eksotermis. Li bereaksi dengan tenang dan sangat lambat, Natrium dan kalium bereaksi dengan keras dan cepat, sedangkan rubidium dan sesium bereaksi dengan keras dan dapat menimbulkan ledakan.

Gambar reaksi natrium dengan air
Reaksi dengan Udara
Logam alkali pada udara terbuka dapat bereaksi dengan uap air dan oksigen. Untuk menghindari hal ini, biasanya litium, natrium dan kalium disimpan dalam minyak atau minyak tanah untuk menghindari terjadinya kontak dengan udara.
Litium merupakan satu-satunya unsur alkali yang bereaksi dengan nitrogen membentuk Li3N. Hal ini disebabkan ukuran kedua atom yang tidak berbeda jauh dan struktur yang dihasilkanpun sangat kompak dengan energi kisi yang besar.
Produk yang diperoleh dari reaksi antara logam alkali dengan oksigen yakni berupa oksida logam. Berikut reaksi yang terjadi antara alkali dengan oksigen
4M + O2 ―→ 2L2O (L = logam alkali)
Pada pembakaran logam alkali, oksida yang terbentuk bermacam-macam tergantung pada jumlah oksigen yang tersedia. Bila jumlah oksigen berlebih, natrium membentuk peroksida, sedangkan kalium, rubidium dan sesium selain peroksida dapat pula membentuk membentuk superoksida. Persamaan reaksinya
Na(s) + O2(g) ―→ Na2O2(s)
L(s) + O2(g) ―→ LO2(s) (L = kalium, rubidium dan sesium)
Reaksi dengan Hidrogen
Dengan pemanasan logam alkali dapat bereaksi dengan hidrogen membentuk senyawa hidrida. Senyawa hidrida yaitu senyawaan logam alkali yang atom hidrogen memiliki bilangan oksidasi -1.
2L(s) + H2(g) ―→ 2LH(s) (L = logam alkali)
Reaksi dengan Halogen
Unsur-unsur halogen merupakan suaru oksidator sedangkan logam alkali merupakan reduktor kuat. Oleh sebab itu reaksi yang terjadi antara logam alkali dengan halogen merupakan reaksi yang kuat. Produk yang diperoleh dari reaksi ini berupa garam halida.
2L + X2 ―→ 2LX (L = logam alkali, X = halogen)
Reaksi dengan Senyawa
Logam-logam alkali dapat bereaksi dengan amoniak bila dipanaskan dan akan terbakar dalam aliran hidrogen klorida.
2L + 2HCl ―→ LCl + H2
2L + 2NH3 ―→ LNH2 + H2 L = logam alkali
Kegunaan Logam Alkali dan Beberapa Senyawa Alkali
Natium merupakan salah satu logam alkali yang dimanfaatkan untuk pembuatan lampu. Lampu ini dikenal dengan nama lampu natrium. Lampu natrium umumnya digunakan sebagai lampu penerangan dijalan-jalan raya. Lampu natrium ditandai dengan warna kuning cemerlang yang mampu menembusi kabut. Dibanding logam murninya, senyawa-senyawa yang dibentuk dari logam alkali lebih banyak dimanfaatkan.
Beberapa Senyawaan Natrium dan Kalium Serta Kegunaannya
Senyawaan Natrium
-
Natrium klorida (NaCl), merupakan bahan baku pembuatan garam dapur, NaOH, Na2CO3.
-
Natrium hidrosida atau soda kaustik (NaOH). Digunakan dalam industri pembuatan sabun, kertas dan tekstil, dalam kilng minyak digunakan untuk menghilangkan belerang, dan ekstraksi aluminium dari bijihnya. Dalam laboratorium digunakan untuk menyerap gas karbondioksida atau gas-gas lain yang bersifat asam, dalam beberapa reaksi organik NaOH merupakan pereaksi yang penting misalnya pada reaksi hidrolisis.
-
Soda cuci (Na2CO3), pelunak kesadahan air, zat pembersih (cleanser) peralatan rumah tangga, industri gelas.
-
Natrium hidroksi karbonat (NaHCO3) atau soda kue, campuran pada minuman dalam botol (beverage) agar menghasilkan.
-
Natrium nitrat (NaNO3), pupuk, sebagai pereaksi dalam pembuatan senyawa nitrat yang lain.
-
Natrium nitrit (NaNO2), pembuatan zat warna (proses diazotasi), pencegahan korosi.
-
Natrium sulfat (Na2SO4) atau garam Glauber, obat pencahar (cuci perut), zat pengering untuk senyawa organik.
-
Natrium tiosulfat (Na2S2O3), larutan pencuci (hipo) dalam fotografi.
-
Na3AlF6, pelarut dalam sintesis logam alumunium.
-
Natrium sulfat dekahidrat (Na2SO4.10H2O) atau garam glauber: digunakan oleh industri pembuat kaca.
-
Na3Pb8 : sebagai pengisi lampu Natrium.
-
Natrium peroksida (Na2O2): pemutih makanan.
-
Na-benzoat, zat pengawet makanan dalam kaleng, obat rematik.
-
Na-sitrat, zat anti beku darah.
-
Na-glutamat, penyedap masakan (vetsin).
-
Na-salsilat, obat antipiretik (penurun panas).