Tembaga atau cuprum dalam tabel periodik yang memiliki lambang Cu dan nomor atom 29. Tembaga di alam tidak begitu melimpah dan ditemukan dalam bentuk bebas maupun dalam bentuk senyawaan. Bijih tembaga yang terpenting yaitu pirit atau chalcopyrite (CuFeS2), copper glance atau chalcolite (Cu2S), cuprite (Cu2O), malaconite (CuO) dan malachite (Cu2(OH)2CO3) sedangkan dalam unsur bebas ditemukan di Northern Michigan Amerika Serikat.
Dalam jumlah kecil tembaga ditemukan pada beberapa jenis tanaman, bulu-bulu burung terutama yang berbulu terang dan dalam darah binatang-binatang laut seperti udang dan kerang.
Pengolahan Bijih Tembaga
Bijih tembaga dapat berupa karbonat, oksida dan sulfida. Untuk memperoleh tembaga dari bijih yang berupa oksida dan karbonat lebih mudah dibanding bijih yang berupa sulfida. Hal ini disebabkan tembaga terletak dibagian bawah deret volta sehingga mudah diasingkan dari bijihnya.
Bijih berupa oksida dan karbonat direduksi menggunakan kokas untuk memperoleh tembaga, sedangkan bijih tembaga sulfida, biasanya kalkopirit (CuFeS2), terdiri dari beberapa tahap untuk memperoleh tembaga, yakni:
Pengapungan (flotasi)

Gambar kalkopirit dari wikipedia
Proses pengapungan atau flotasi di awali dengan pengecilan ukuran bijih kemudian digiling sampai terbentuk butiran halus. Bijih yang telah dihaluskan dimasukkan ke dalam campuran air dan suatu minyak tertentu. Kemudian udara ditiupkan ke dalam campuran untuk menghasilkan gelembung-gelembung udara. Bagian bijih yang mengandung logam yang tidak berikatan dengan air akan berikatan dengan minyak dan menempel pada gelembung-gelembung udara yang kemudian mengapung ke permukaan. Selanjutnya gelembung-gelembung udara yang membawa partikel-partikel logam dan mengapung ini dipisahkan kemudian dipekatkan.
Pemanggangan
Bijih pekat hasil pengapungan selanjutnya dipanggang dalam udara terbatas pada suhu dibawah titik lelehnya guna menghilangkan air yang mungkin masih ada pada saat pemekatan dan belerang yang hilang sebagai belerang dioksida.

Campuran yang diperoleh dari proses pemanggangan ini disebut calcine, yang mengandung Cu2S, FeO dan mungkin masih mengandung sedikit FeS. Setelah itu calcine disilika guna mengubah besi(II) oksida menjadi suatu sanga atau slag besi(II) silikat yang kemudian dapat dipisahkan. Reaksinya sebagai berikut

Tembaga(I) sulfida yang diperoleh pada tahap ini disebut matte dan kemungkinan masih mengandung sedikit besi(II) sulfida
Reduksi
Cu2S atau matte yang yang diperoleh kemudian direduksi dengan cara dipanaskan dengan udara terkontrol, sesuai reaksi
2Cu2S(s) + 3O2(g) ―→ 2Cu2O(s) + 2SO2(g)
Cu2S(s) + 2Cu2O(s) ―→ 6Cu(s) + SO2(g)
Tembaga yang diperoleh pada tahap ini disebut blister atau tembaga lepuhan sebab mengandung rongga-rongga yang berisi udara.
Elektrolisis
Blister atau tembaga lepuhan masih mengandung misalnya Ag, Au, dan Pt kemudian dimurnikan dengan cara elektrolisis. Pada elektrolisis tembaga kotor (tidak murni) dipasang sebagai anoda dan katoda digunakan tembaga murni, dengan elektrolit larutan tembaga(II) sulfat (CuSO4). Selama proses elektrolisis berlangsung tembaga di anoda teroksidasi menjadi Cu2+ kemudian direduksi di katoda menjadi logam Cu.
Katoda : Cu2+(aq) + 2e ―→ Cu(s)
Anoda : Cu(s) ―→ Cu2+(aq) + 2e
Pada proses ini anoda semakin berkurang dan katoda (tembaga murni) makin bertambah banyak, sedangkan pengotor-pengotor yang berupa Ag, Au, dan Pt mengendap sebagai lumpur.
Sifat fisika
1) Tembaga merupakan logam yang berwarna kunign seperti emas kuning seperti pada gambar dan keras bila tidak murni.

2) Mudah ditempa (liat) dan bersifat mulur sehingga mudah dibentuk menjadi pipa, lembaran tipis dan kawat.
3) Konduktor panas dan listrik yang baik, kedua setelah perak.
Beberapa Sifat Kimia Tembaga
1) Tembaga merupakan unsur yang relatif tidak reaktif sehingga tahan terhadap korosi. Pada udara yang lembab permukaan tembaga ditutupi oleh suatu lapisan yang berwarna hijau yang menarik dari tembaga karbonat basa, Cu(OH)2CO3.
2) Pada kondisi yang istimewa yakni pada suhu sekitar 300 °C tembaga dapat bereaksi dengan oksigen membentuk CuO yang berwarna hitam. Sedangkan pada suhu yang lebih tinggi, sekitar 1000 ºC, akan terbentuk tembaga(I) oksida (Cu2O) yang berwarna merah.
3) Tembaga tidak diserang oleh air atau uap air dan asam-asam nooksidator encer seperti HCl encer dan H2SO4 encer. Tetapi asam klorida pekat dan mendidih menyerang logam tembaga dan membebaskan gas hidrogen. Hal ini disebabkan oleh terbentuknya ion kompleks CuCl2¯(aq) yang mendorong reaksi kesetimbangan bergeser ke arah produk.
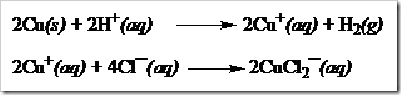
Asam sulfat pekatpun dapat menyerang tembaga, seperti reaksi berikut

4) Asam nitrat encer dan pekat dapat menyerang tembaga, sesuai reaksi
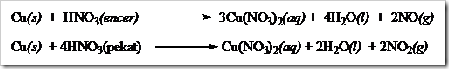
5) Tembaga tidak bereaksi dengan alkali, tetapi larut dalam amonia oleh adanya udara membentuk larutan yang berwarna biru dari kompleks Cu(NH3)4+.
6) Tembaga panas dapat bereaksi dengan uap belerang dan halogen. Bereaksi dengan belerang membentuk tembaga(I) sulfida dan tembaga(II) sulfida dan untuk reaksi dengan halogen membentuk tembaga(I) klorida, khusus klor yang menghasilkan tembaga(II) klorida.
Pemakaian tembaga
a) Sebagai bahan untuk kabel listrik dan kumparan dinamo.
b) Paduan logam. Paduan tembaga 70% dengan seng 30% disebut kuningan, sedangkan paduan tembaga 80% dengan timah putih 20% disebut perunggu. Perunggu yang mengandung sejumlah fosfor digunakan dalam industri arloji dan galvanometer. Kuningan memiliki warna seperti emas sehingga banyak digunakan sebagai perhiasan atau ornamen-ornamen. Sedangkan perunggu banyak dijadikan sebagai perhiasan dan digunakan pula pada seni patung. Kuningan dan perunggu berturut-turut seperti yang tertera pada gambar


c) Mata uang dan perkakas-perkakas yang terbuat dari emas dan perak selalu mengndung tembaga untuk menambah kekuatan dan kekerasannya. Gambar mata uang yang terbuat dari emas:

d) Sebagai bahan penahan untuk bangunan dan beberapa bagian dari kapal.
e) Serbuk tembaga digunakan sebagai katalisator untuk mengoksidasi metanol menjadi metanal.
Senyawaan tembaga
Tembaga di alam memiliki tingkat oksidasi +1 dan +2. Tembaga dengan bilangan oksidasi +2 merupakan tembaga yang sering ditemukan sedangkan tembaga dengan bilangan oksidasi +1 jarang ditemukan, karena senyawaan tembaga ini hanya stabil jika dalam bentuk senyawa kompleks. Selain dua keadaan oksidasi tersebut dikenal pula tembaga dengan bilangan oksidasi +3 tetapi jarang digunakan, misalnya K3CuF6. Beberapa senyawaan yang dibentuk oleh tembaga seperti yang tertera pada Tabel.
|
Tembaga(II)
|
Nama
|
Tembaga(I)
|
Nama
|
|
CuO
Cu(OH)2
CuCl2
CuF2
CuS
CuSO4.5H2O
Cu(NO3)2.3H2O
|
tembaga(II) oksida
tembaga(II) hidroksida
tembaga(II) klorida
tembaga(II) fluorida
tembaga(II) sulfida
tembaga(II) sulfat pentahidrat atau vitriol biru
tembaga(II) nitrat trihidrat
|
Cu2O
CuCl
CuI
|
tembaga(I) oksida
tembaga(I) klorida
tembaga(I) iodida
|



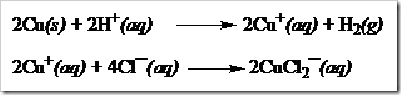
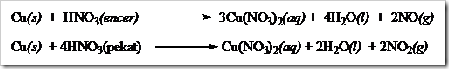






saya tidak menemukan keterangan bahwa, apakah tembaga dapat meredam panas? dan dapat memperkuat sinyal internet?
Pingback: KHARAKTERISTIK ATOM TEMBAGA (Cu) « Afif Fadilaeni