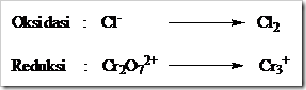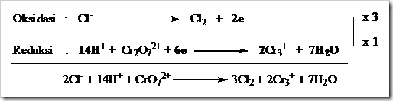Pada semua reaksi kimia selalu berlaku hukum kekekalan massa. Oleh karena itu pada persamaan reaksi diberikan koefisien tertentu dan koefisien tersebut menyatakan mol atom yang terdapat pada reaktan dan produk. Berdasarkan hukum kekekalan massa maka jumlah mol pada reaktan harus sama dengn jumlah mol yang terdapat pada produk.
Reaksi-reaksi redoks yang sederhana dapat diselesaikan dengan cepat tanpa diperlukan suatu langkah penyetaraan yang khusus, namun untuk reaksi yang cukup kompleks penyetaraan diperlukan cara-cara khusus. Hingga saat ini dikenal dua metoda khusus penyetaraan redoks yaitu metoda bilangan oksidasi dan metoda stengah reaksi.
Metoda Bilangan Oksidasi (Oxidation Number Method)
Penyetaraan reaksi dengan metode bilangan oksidasi didasarkan pada perubahan bilangan oksidasi yang dari spesi yang mengalami oksidasi atau reduksi. Berikut beberapa hal yang perlu diperhatikan dalam cara ini, yaitu:
– Jumlah bilangan oksidasi unsur yang dioksidasi harus sama dengan jumlah berkurangnya bilangan oksidasi unsur yang direduksi.
– Jumlah (aljabar) muatan ion pada reaktan dan produk harus sama. Tetapi terkadang ion-ion yang tidak mengalami perubahan bilangan oksidasi sering tidak ditulis.
– Suasana berlangsungnya reaksi.
Tahap-tahap penyetaran reaksi redoks beserta aplikasinya pada penyetaraan reaksi redoks yang berlangsung dalam suasana asam:
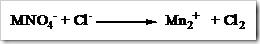
Tahap 1: Identifikasi unsur-unsur yang mengalami perubahan bilangan oksidasi pada reaktan maupun produk.
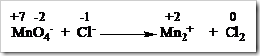
Tahap 2: Samakan jumlah atom unsur yang mengalami perubahan bilangan oksidasi diruas kiri dengan ruas kanan dengan memberi koefisien yang sesuai.

Tahap 3: Hitung jumlah bertambah dan berkurangnya bilangan oksidasi.
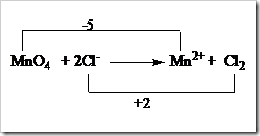
Tahap 4: Samakan jumlah bertambah dan berkurangnya bilangan oksidasi. Pada tahap ini jumlah berkurang bilangan oksidasi Mn menjadi Mn2+ (tahap 3) dikali dengan koefisien Cl¯ dan Cl2, begitupun sebaliknya jumlah bertambahnya bilangan oksidasi Cl¯ menjadi Cl2 dikali dengan koefisien MnO4 dan Mn2+.

Tahap 5: Samakan jumlah muatan-muatan ion diruas kiri dan kanan dengan menambah ion H+, karena reaksi berlangsung dalam suasana asam.

Tahap 6: Menambah H2O pada pada ruas yang kekurangan atom H untuk menyetarakan jumlah atom H di ruas kiri dan kanan.

Penyetaraan reaksi redoks yang berlangsung dalam suasana basa pada dasarnya sama dengan tahap-tahap penyetaraan reaksi redoks yang berlangsung dalam suasana asam. Perbedaannya terletak pada tahap 5 yakni pada suasana asam ditambah H+ sedangkan pada suasana basa ditambah OH¯ untuk menyamakan jumlah muatan reaktan dengan produk. Berikut contoh menyetarakan reaksi redoks yang berlangsung dalam suasan basa untuk reaksi berikut:
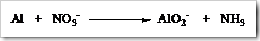
Tahap 1: Identifikasi unsur-unsur yang mengalami perubahan bilangan oksidasi pada reaktan maupun produk.
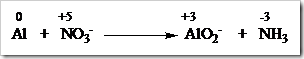
Tahap 2: Samakan jumlah atom unsur yang mengalami perubahan bilangan oksidasi diruas kiri dan kanan dengan memberi koefisien yang sesuai.
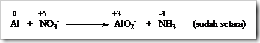
Tahap 3: Hitung jumlah bertambah dan berkurangnya bilangan oksidasi.
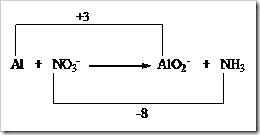
Tahap 4: Samakan jumlah bertambah dan berkurangnya bilangan oksidasi.
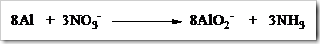
Tahap 5: Samakan jumlah muatan-muatan ion diruas kiri dan kanan dengan menambah ion OH¯, karena reaksi berlangsung dalam suasana basa.

Tahap 6: Menambah H2O pada pada ruas yang kekurangan atom H untuk menyetarakan jumlah atom H di ruas kiri dan kanan.

Metode Setengah Reaksi
Tahap-tahap menyetarakan reaksi redoks dengan metode setengah reaksi (half reaction method) atau metode ion elektron berbeda dengan metode bilangan oksidasi tetapi memberikan hasil akhir yang sama. Berikut beberapa hal yang perlu diperhatikan pada cara ini, yaitu:
– Persamaan reaksi redoks merupakan penjumlahan dua setengah reaksi.
– Jumlah elektron yang dilepaskan pada oksidasi sama dengan jumlah elektron yang ditangkap pada reaksi reduksi.
– Suasana berlangsungnya reaksi.
Contoh soal
Setararakan reaksi-reaksi berikut yang berlangsung dalam suasana asam:

Tahap 1: Identifikasi unsur-unsur yang mengalami perubahan bilangan oksidasi.
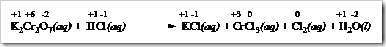
Dari bilangan oksidasi yang telah dihitung dari masing-masing spesi diketahui biloks Cr turun dari +6 menjadi +3 sedangkan Cl tambah dari -1 menjadi +1. Maka pada reaksi ini Cr mengalami reduksi dan Cl mengalami oksidasi.
Tahap 2: Menulis secara terpisah spesi yang mengalami osidasi dengan yang mengalami reduksi (setengah reaksi).
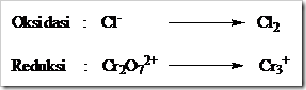
Tahap 3: Setarakan jumlah atom yang mengalami oksidasi dan reduksi diruas kiri dan kanan dengan memberi koefisien yang sesuai.

Tahap 4: Setarakan jumlah atom O dengan menambahkan H2O pada sisi yang kekurangan atom O.
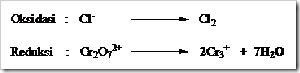
Tahap 5: Setarakan jumlah atom H, dengan menambahkan ion H+ pada sisi yang kekurangan atom H.

Tahap 6: Setarakan jumlah muatan dengan menambahkan elektron pada sisi setengah reaksi yang kelebihan muatan positif. Untuk reaksi oksidasi elektron selalu ditambahkan ruas kanan sedangkan reaksi reduksi selalu ditambah disebelah kiri.

Tahap 7: Gabungkan dua setengah reaksi kemudian menyamakan jumlah elektron yang dilepaskan pada reaksi oksidasi dengan jumlah elektron yang diterima pada reaksi reduksi. Bagian yang sama dapat dicoret.
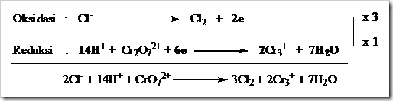
Untuk reaksi yang berlangsung dalam suasana basa tahap-tahap penyetaraan seperti pada suasana asam, perbedaan terletak pada tahap akhir. Misalnya setarakan reaksi berikut yang berlangsung dalam suasana basa:
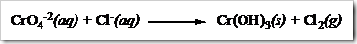
Tahap 1: Mengidentifikasi unsur-unsur yang mengalami perubahan bilangan oksidasi. 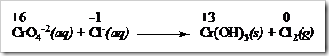
Tahap 2: Menulis secara terpisah spesi yang mengalami osidasi dengan yang mengalami reduksi (setengah reaksi).
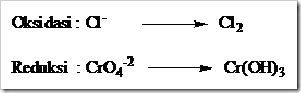
Tahap 3: Setarakan jumlah atom yang mengalami oksidasi dan reduksi diruas kiri dan kanan dengan memberi koefisien yang sesuai.
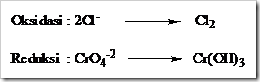
Tahap 4: Setarakan jumlah atom O dengan menambahkan H2O pada sisi yang kekurangan atom O.
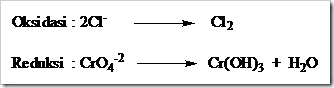
Tahap 5: Setarakan jumlah atom H, dengan menambahkan ion H+ pada sisi yang kekurangan atom H.

Tahap 6: Setarakan jumlah muatan dengan menambahkan elektron pada sisi setengah reaksi yang kelebihan muatan positif atau kurang negatif. Untuk reaksi oksidasi elektron selalu ditambahkan ruas kanan sedangkan reaksi reduksi selalu ditambah disebelah kiri.

Tahap 7: Gabungkan dua setengah reaksi kemudian menyamakan jumlah elektron yang dilepaskan pada reaksi oksidasi dengan jumlah elektron yang diterima pada reaksi reduksi.

Karena reaksi berlangsung dalam suasana basa maka ion H+ yang ada harus dinetralkan. Hal ini dapat dilakukan dengan cara menambah ion OH¯ pada kedua ruas dan ion OH¯ yang ditambahkan sama dengan jumlah ion H+ yang ada. Pada reaksi di atas terdapat 10 ion H+ maka ditambahkan 10 ion OH¯. Jadi persamaannya dapat ditulis sebagai:

10 ion H+ dan 10OH¯ pada reaktan (ruas kiri) dapat bergabung membentuk 10 molekul air.

10 molekul air yang terbentuk di kurangi 2 molekul air di produk (ruas kanan) sehingga persamaan reaksinya menjadi: