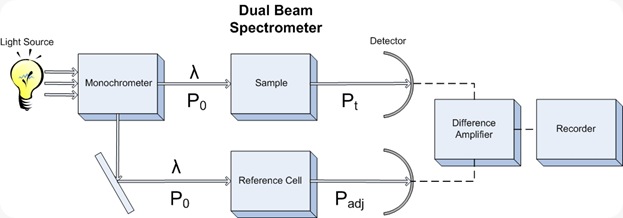
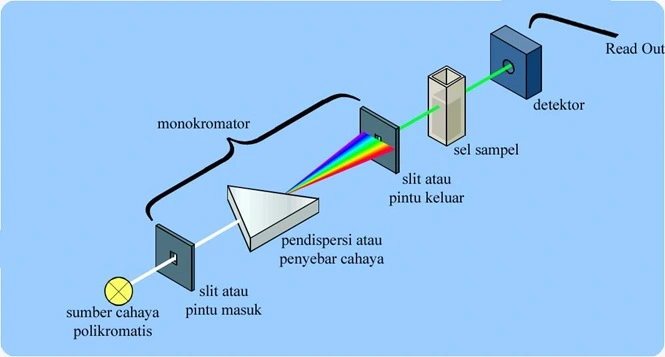
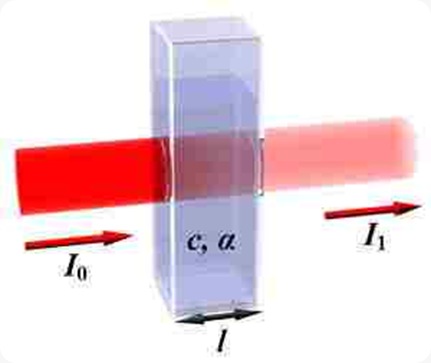
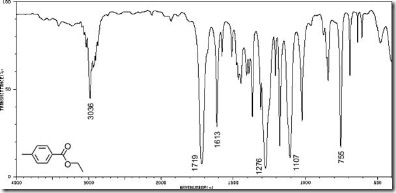
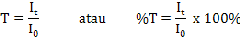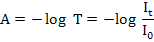Spektrofotometri UV merupakan salah satu metode analisis yang dilakukan dengan pangjang gelombang 100-400 nm atau 595–299 kJ/mol. Sinar ultraviolet atau sinar ungu terbagi menjadi dua jenis yaitu
· Ultraviolet jauh
· Ultaviolet dekat
Ultraviolet jauh memiliki rentang panjang gelombang ± 10 – 200 nm, sedangkan ultraviolet dekat memiliki rentang panjang gelombang ± 200-400 nm. Cahaya UV tidak bisa dilihat oleh manusia, namun beberapa hewan, termasuk burung, reptil dan serangga seperti lebah dapat melihat sinar pada panjang gelombang UV.
Pada spektrofotometer UV biasanya menggunakan lampu deuterium atau disebut juga heavi hidrogen sebagai sumber cahaya. Deuterium merupakan salah satu isotop hidrogen yang memiliki 1 proton dan 1 neutron pada intinya. Deuterium berbeda dengan hidrogen yang hanya memiliki 1 neutron tanpa proton. Air yang atom hidrogennya merupakan isotop deuterium dinamakan air berat (D2O).
Air berat digunakan sebagai moderator neutron dan pendingin pada reaktor nuklir. Deuterium juga berpotensi sebagai bahan bakar fusi nuklir komersial. Perlu diketahui air berat yang dibekukan (es) dapat tenggelam dalam air karena massa jenisnya lebih besar dari massa jenis air. Hal ini, tentu berbeda dengan es yang dibuat dari air (H2O) yang mengapung bila dimasukan dalam air karena massa jenisnya lebih kecil dari air.
Zat yang dapat dianalisis menggunakan spektrofotometri UV adalah zat dalam bentuk larutan dan zat tersebut tidak tampak berwarna. Jika zat tersebut berwarna maka perlu direaksikan dengan reagen tertentu sehingga dihasilkan suatu larutan tidak berwarna. Namun biasanya zat yang berwarna lebih banyak dianalisis menggunakan spektrofotometri sinar tampak.
Senyawa-senyawa organik sebagian besar tidak tidak berwarna sehingga spektrofotometer UV lebih banyak digunakan dalam analisis senyawa organik khususnya dalam penentuan struktur senyawa organik.
Larutan-larutan tidak berwarna yang dianalisis menggunakan spektrofotometer UV tidak boleh ada partikel koloid ataupun suspensi. Karena adanya partikel-partikel koloid ataupun suspensi akan memperbesar absorbansi, akibatnya bila dihubungkan dengan rumus yang diturunkan dari hukum Lambaert-Beer konsentrasi zat yang dianalisis makin besar dan apabila digunakan untuk penentuan struktur suatu senyawa maka pita pada spektrum akan melebar dari yang sesungguhnya.
Analisis menggunakan sinar ultraviolet biasanya dilakukan menggunakan ultraviolet dekat, sedangkan analisis menggunakan ultraviolet jauh maka instrumen yang digunakan harus dalam keadaan vakum.
Hal ini disebabkan jika digunakan ultraviolet jauh maka udara akan ikut menyerap panjang gelombang yang digunakan. Akbatnya kesalahan yang dilakukan makin fatal, karena jika udara ikut menyerap maka absorbansi yang dihasilkan akan makin besar, jika hal ini dihubungkan dengan hukum Lamber-Beer maka konsentrasi zat yang dianalisis lebih tinggi dari yang seharusnya.
Perhitungan konsentrasi suatu spesi yang ada dalam suatu larutan dapat dilakukan dengan cara kurva kalibarasi seperti yang telah dijelaskan di Spektrofotometri sinar tampak (Visible).
Penggunaan UV Untuk Penentuan Struktur Molekul
Penggunaan UV untuk analisis senyawa organik (penentuan struktur senyawa organik) terdapat beberapa istilah yang biasa digunakan yaitu:
1) Kromofor. Kromofor berasal dari bahasa latin yang artinya “chromophorus” yang berarti pembawa warna. Pada mulanya pengertian kromofor digunakan untuk sistem yang menyebabkan terjadinya warna pada suatu senyawa. Kemudian diperluas menjadi suatu gugus fungsi yang mengabsorbsi radiasi elektromagnetik, termasuk yang tidak memberikan warna. Jadi kromofor adalah gugus fungsi yang menyerap atau mengabsorbsi radiasi elektromagnetik di daerah panjang gelombang ultraviolet dan daerah cahaya tampak. Contoh kromofor: C=O, C=C, N=N dan NO2.
2) Auksokrom (Auxochrom = auxiliary chromophores), yakni gugus yang berpengaruh (namun sedikit) terhadap absorpsi UV, tetapi berdampak cukup signifikan pada absorbansinya (lmaks dan e ). Contoh gugus auksokrom adalah : –OH, –OR, dan –NHR. Secara umum gugus-gugus auksokrom dicirikan oleh adanya pasangan elektron bebas yang terdapat pada gugus yang bersangkutan.
3) Geseran batokromat atau geseran batokromik (Bathochromic shift) atau geseran merah, yakni geseran atau perubahan lmaks ke arah yang lebih besar. Penyebab terjadinya peristiwa ini adalah adanya perubahan struktur, misalnya adanya auksokrom atau adanya pergantian pelarut.
4) Geseran hipsokromat (Hypsochromic shift) atau pergeseran hipokromik atau pergeseran biru, yakni geseran atau perubahan lmaks ke arah yang lebih kecil. Munculnya gejala ini juga sering disebabkan oleh adanya penghilangan auksokrom atau oleh adanya pergantian pelarut.
|
dari penjelasan-penjelasan dapat disimpulkan, suatu auksokrom dan pergantian pelarut dapat menimbulkan geseran batokromat dan hipsokromat
|
Transisi Elektronik
Energi yang dimiliki sinar UV mampu menyebabkan perpindahan elektron (promosi elektron) atau yang disebut transisi elektronik. Transisi elektronik dapat diartikan sebagai perpindahan elektron dari satu orbital ke orbital yang lain.
Disebut transisi elektronik karena elektron yang menempati satu orbital dengan energi terendah dapat berpindah ke orbital lain yang memiliki energi lebih tinggi jika menyerap energi, begitupun sebaliknya elektron dapatberpindah dari orbital yang memiliki energi lebih rendah jika melepaskan energi. Energi yang diterima atau diserap berupa radiasi elektromagnetik.
Berdasarkan mekanika kuantum transisi elektronik yang dibolehkan atau tidak dibolehkan (terlarang) disebut kaidah seleksi. Berdasarkan kaidah seleksi, suatu transisi elektronik termasuk:
1. Transisi diperbolehkan bila nilai ε sebesar 103 sampai 106.
2. Transisi terlarang bila nilai ε sebesar 10-3 sampai 103.
Selain dengan melihat harga ε kaidah seleksi dapat dapat dinyatakan dengan simetri dan spin. Berdasarkan simetri dan spin suatu transisi elektronik diperbolehkan bila:
1. Berlangsung antara orbital-orbital dalam bidang yang sama.
2. Selama transisi orientasi spin harus tetap.
Dalam satu molekul terdapat dua jenis orbital yakni Orbital Ikatan (bonding orbital) dan Orbital Anti-ikatan (antibonding orbital). Orbital ikatan di bagi menjadi beberapa jenis yakni orbital ikatan sigma (σ, = ikatan tunggal) dan orbital phi (π, = ikatan rangkap), sedangkan orbital nonikatan berupa elektron bebas yang biasanya dilambangkan dengan n. Orbital nonikatan umumnya terdapat pada molekul-molekul yang mengandung atom nitrogen, oksigen, sulfur dan halogen.
Orbital ikatan sigam (σ) dan orbital phi (π) terbentuk karena terjadinya tumpang tindih dua orbital atom atau orbital-orbital hibrida. Dari dua orbital atom dapat dibentuk dua orbital molekul yakni orbital ikatan dan orbital anti ikatan.
Dengan demikian jika suatu molekul mempunyai orbital ikatan maka molekul tersebut mempunyai orbital anti ikatan. Orbital anti-ikatan biasanya diberi notasi atau tanda asterisk atau bintang (*) pada setiap orbital yang sesuai. Orbital ikatan α orbital anti-ikatannya adalah α*, sedangkan orbital ikatan π orbital anti-ikatannya adalah π*.
Transisi elektronik atau perpindahan elektron dapat terjadi dari orbital ikatan ke orbital anti-ikatan atau dari orbital non-ikatan (nonbonding orbital) ke orbital anti-ikatan. Terjadinya transisi elektronik atau promosi elektron dari orbital ikatan ke orbital antiikatan tidak menyebabkan terjadinya disosiasi atau pemutusan ikatan, karena transisi elektronik terjadi dengan kecepatan yang jauh lebih tinggi dari pada vibrasi inti.
Pada transisi elektronik inti-inti atom dapat dianggap berada pada posisi yang tepat. Hal ini dikenal dengan prinsip Franck-Condon. Disamping itu dalam proses transisi ini tidak semua elektron ikatan terpromosikan ke orbital antiikatan.
Berdasarkan jenis orbital tersebut maka, jenis-jenis transisi elektronik dibedakan menjadi empat macam, yakni:
1) Transisi σ → σ*
2) Transisi π → π*
3) Transisi n → π*
4) Transisi n → σ*
Keterangan
· σ : senyawa-senyawa yang memiliki ikatan tunggal
· π : senyawa-senyawa yang memiliki ikatan rangkap
· n menyatakan orbital non-ikatan: untuk senyawa-senyawa yang memiliki elektron bebas.
· σ* dan π* merupakan orbital yang kosong (tanpa elektron), orbital ini akan terisi elektron ketika telah atau bila terjadi eksitasi elektron atau perpindahan elektron atau promosi elektron dari orbital ikatan.
Energi yang diperlukan untuk menyebabkan terjadinya transisi berbeda antara transisi satu dengan transisi yang lain. Transisi σ ke σ* memerlukan energi paling besar, sedangkan energi terkecil diperlukan untuk transisi dari n ke π.
Untuk memberikan gambaran dan memudahkan pemahaman tentang jenis transisi beserta perbandingan energi yang diperlukan dapat dilihat pada gambar berikut:
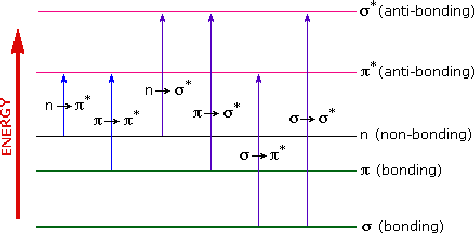
Pada gambar di atas transisi dari σ ke π* sebenarnya tidak ada. Transisi demikian dapat pula terjadi tapi sangat kecil sehingga tidak dapat diamati pada spektrum atau spektra. Karena bertolak belakang dengan kaidah seleksi.
Pada setiap jenis transisi elektronik yang terjadi, terdapat karakter dan melibatkan energi yang berbeda. Suatu kromofor dengan pasangan elektron bebas (n) dapat menjalani transisi dari orbital non-ikatan (n) ke orbital anti-ikatan, baik pada obital sigma bintang (α*) maupun phi bintang(π*). Sedangkan, kromofor dengan elektron ikatan rangap (menghuni orbital phi) akan menjalani transisi dari orbital π ke orbital π*. Demikian seterusnya untuk jenis transisi yang lain.
Dalam penentuan struktur molekul, tansisi σ → σ* tidak begitu penting karena puncak absorbsi berada pada daerah ultraviolet vakum yang berarti tidak terukur oleh peralatan atau instrumen pada umumnya.
Walaupun transisi π→π* pada ikatan ganda terisolasi mempunyai puncak absorbsi di daerah UV vakum tetapi transisi π→π* tergantung pada konjugasi ikatan ganda dengan suatu gugus fungsi substituen. Akibatnya transisi π→π* pada ikatan ganda terkonjugasi mempunyai puncak absorbsi pada daerah ultraviolet dekat, dengan panjang gelombang lebih besar dari 200 nm. Dengan demikian transisi yang penting dalam penentuan struktur molekul adalah transisi π→π* serta beberapa transisi n→π* dan n→σ*.
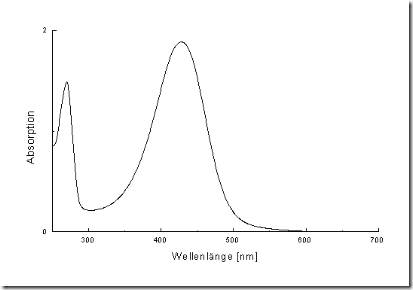
Anaslisis menggunakan spektrofotometer UV, senyawa-senyawa dengan kromofor yang sama, misalnya sama-sama ada ikatan rangkap atau ada elektron bebas, maka akan memberikan spektrum yang sama atau hampir sama walaupun strkturnya molekulnya berbeda. Contoh dapat di lihat pada Gambar berikut.
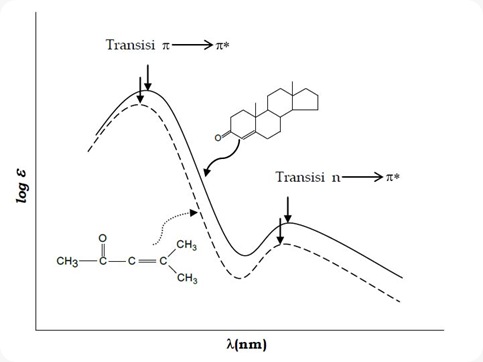
Pola pita absorpsi UV untuk dua senyawa dengan kromofor yang sama
Pengaruh ikatan konjugasi pada lmaks
Sesuai dengan uraian tentang transisi π→π* pengaruh adanya ikatan konjugasi pada suatu struktur yang mempunyai ikatan π adalah menggesar lmaks ke nilai yang lebih besar atau pergeseran batokromat.
Hal ini dapat dilihat pada lmaks etana dan beberapa poliena pada tabel:
|
senyawa
|
lmaks (nm)
|
|
Etena
1,3-butadiena
1,3,5-heksatriena
1,3,5,7-oktatriena
|
165
217
251
304
|
Perpanjangan ikatan rangkap tekonjugasi menggeser λmaks ke arah makin besar karena makin mudah menjalani terjadinya transisi π→π* sehingga transisi ini hanya memerlukan energi yang kecil (panjang gelombang besar). Terjadinya pergeseran lmaks karena orbital π masing-masing ikatan π berinteraksi membentuk seperangkat orbital ikatan dan anti ikatan yang baru. Orbital-orbital baru tersebut mempunyai tingkat energi yang berbeda dengan orbital dalam ikatan ganda yang terisolasi.
Diagram skematik perbedaan pola transisi π→ π*pada satu ikatan rangkap C=C dan ikatan rangkap C=C terkonjugasi ditunjukan pada Gambar berikut.
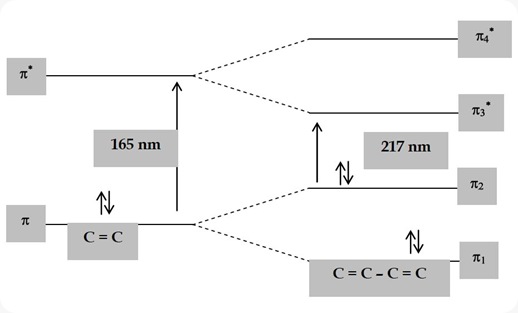
Gambar Pola transisi elektronik suatu diena dan diena terkonjugasi
Bila sistem konjugasi semakin panjang atau jumlah ikatan rangkap terkonjugasi semakin banyak maka perbedaan energi antara keadaan dasar dengan keadaan tereksitasi yang melibatkan transisi π→π* akan semakin kecil. Dengan demikian sistem konjugasi bertambah panjang maka energi yang diperlukan untuk transisi π→π* semakin kecil, sehingga puncak absorbsi akan terjadi pada panjang gelombang yang semakin besar.
Konjugasi yang cukup panjang dapat menggeser puncak absorbsi sampai ke panjang gelombang pada daerah sinar tampak sehingga suatu senyawa menjadi berwarna. Sebagai contoh likopena yang menyebabkan tomat berwarna merah. Dalam struktur likopena mempunyai sebelas ikatan rangkap terkonjugasi dengan lmaks 505 nm. Struktur likopena dapar dilihat pada Gambar.

Gambar Struktur Likopena, zat pemberi warna merah pada beberapa sayuran dan buah-buahan seperti tomat
Perlu ditekankan, makin panjang konjugasi makin tidak “aktif” daerah UV, tetapi makin aktif pada daerah Visible. Misalnya, untuk delapan atau lebih ikatan rangkap terkonjugasi, maka absorpsi maksimum pada poliena yang demikian mengabsorpsi secara kuat di daerah spektrum visible.
Selain dengan perpanjangan sistem ikatan π, adanya substituen tertentu yang juga dapat menggeser lmaks ke panjang gelombang yang lebih besar atau menyebabkan geseran batokromat. Substituen tersebut dapat berupa gugus atau atom, misalnya gugus metil atau atom halogen. Khusus untuk konjugasi oleh metil dikenal sebagai hiperkonjugasi.
Pengaruh pelarut pada lmaks
Suatu senyawa yang diukur atau akan ditentukan strukturnya biasanya dalam bentuk encer. Pelarut yang biasa digunakan pada spektrofotometer UV adalah pelarut yang tidak mengabsorbsi atau transparan pada panjang gelombang UV.
Pelarut yang biasa digunakan pada spektrofotometer adalah etanol karena sifatnya yang transparan terhadap UV di atas 210 nm. Selain itu heksana (transparan di atas 210 nm), air (transparan di atas 205) dan dioksana juga sering digunakan sebagai pelarut pada spektrofotometer UV.
Air dan etanol termasuk pelarut polar sehingga dapat melarutkan senyawa-senyawa yang bersifat polar sedangkan heksana termasuk pelarut nonpolar sehingga dapat melarutkan senyawa-senyawa yang bersifat nonpolar, sesuai prinsip “Like Dissolve Like“.
Penggunaan pelarut dengan kepolaran yang berbeda menyebabkan posisi puncak absorbsi suatu senyawa bergeser. Dengan kata lain kepolaran pelarut berpengaruh pada lmaks suatu senyawa.
Kepolaran pelarut mempengaruhi λmaks karena kepolaran molekul biasanya berubah jika suatu elektron bergerak dari satu orbital ke orbital lainnya. Pengaruh pelarut biasanya mencapai hingga 20 nm jika digunakan pelarut senyawa-senyawa karbonil.
Pada umumnya transisi π→π* menghasilkan keadaan tereksitasi yang lebih polar dari keadaan dasar molekul itu. Interaksi dipol-dipol antara molekul dalam keadaan tereksitasi dengan molekul-molekul pelarut yang polar, menyebabkan tingkat energi molekul dalam keadaan tereksitasi menjadi turun.
Akibatnya transisi π→π* suatu molekul dalam pelarut polar memerlukan energi yang lebih kecil dari transisi π→π* molekul itu dalam pelarut nonpolar. Pergantian pelarut heksana dengan etanol menggeser lmaks suatu senyawa ke nilai yang lebih besar dengan pergeseran sebesar 10–20 nm.
Untuk membantu memahami bagaimana suatu pelarut polar dapat menstabilkan suatu keadaan tereksitasi, dapat diambil contoh di sini adalah transisi π→π* dalam alkena. Pernyataan spesies pada keadaan dasar dan keadaan tereksitasi dengan konsep sederhana melalui struktur resonansinya sehingga membentuk spesies dipolar (lihat Gambar). Kondisi struktur sebenarnya pada Gambar bukan sebagai keadaan tereksitasi tetapi memberikan kontribusi untuk suatu struktur keadaan tereksitasi.
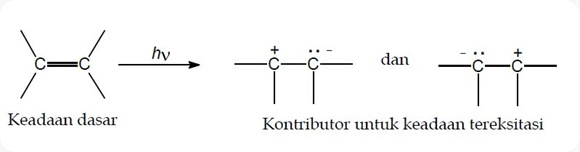
Gambar Struktur resonansi keadaan dasar dan eksitasi untuk alkena
Transisi n→π*, pada keton menunjukan pengaruh yang berlawanan. Molekul-molekul pelarut yang mampu mengadakan ikatan hidrogen berinteraksi lebih kuat dengan molekul pada keadaan dasar daripada dengan molekul pada keadaan tereksitasi.
Transisi n→π* molekul keton dalam pelarut air atau etanol (dalam pelarut polar) terjadi geseran biru (geseran hipsokromat) atau transisi dalan kedua pelarut polar tersebut memerlukan energi yang lebih besar (panjang gelombang lebih kecil) daripada transisi n→π* molekul keton dalam pelarut heksana.
Hal ini disebabkan oleh adanya ikatan hidrogen antara molekul air atau etanol dengan molekul keton pada keadaan dasar. Akibatnya transisi n→π* molekul keton dalam pelarut air atau etanol memerlukan energi yang lebih besar (lmaks yang lebih kecil).
Artikel Yang Disarankan :
1. Pengertian Dasar Spektrofotometer Vis, UV, UV-Vis
2. Spektrofotometri sinar tampak (Visible)
3. Spektrofotometri UV-Vis
4. Cara Membuat Perangkap Nyamuk Sederhana
5. TEORI VSEPR DAN GEOMETRI MOLEKUL
6. ikatan kovalen polar dan nonpolar VS molekul polar dan nonpolar