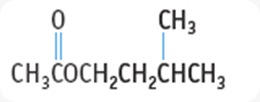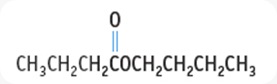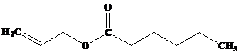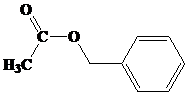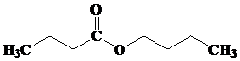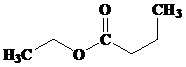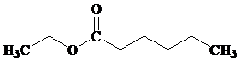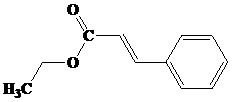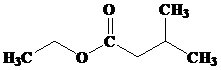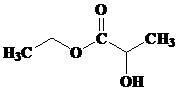!!..Buku Elektronik..!!
download buku-buku semua pelajaran untuk SD, SMP, SMA dan SMK secara gratis, silakan kunjungi situs http://bse.kemdiknas.go.id
CaRiLah Di SiNi
Kategori
- * BUKU GR4TIS
- * SMA KELAS I
- * SMA KELAS II
- * SMA KELAS III
- Eksperimen Kimia
- Humor
- ikatan kimia
- JESUS CHRIST OF NASARET
- Karbon Dan Senyawaannya
- KIMIA
- Komputer Dan Internet
- Logam dan Beberapa Jenis Logam
- Redoks dan elektrokimia
- Soal Kimia dan Pembahasan
- spektroskopi
- Tahukah Anda…?
- Z PICTURE AND WALPAPER
AdA YaNg BaRu NiH
- Hand Out Hukum Faraday
- Jalan-Jalan di Bali
- CONTOH SOAL DAN PEMBAHASAN LAJU REAKSI
- Briket Kulit Durian
- KORUPSI : Peninggalan Nenek Moyang Penghias Media Masa
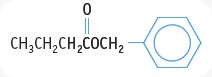
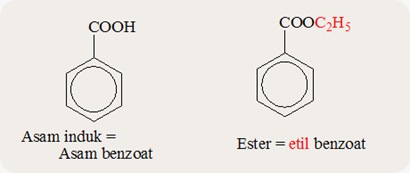
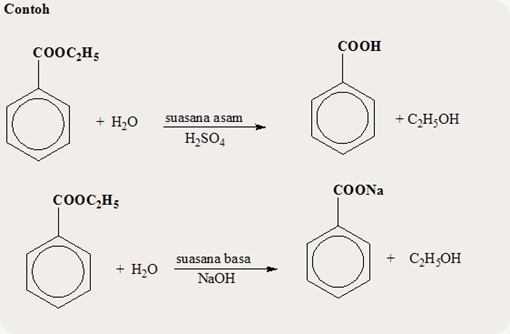
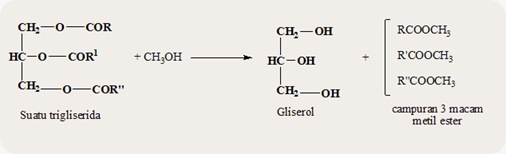
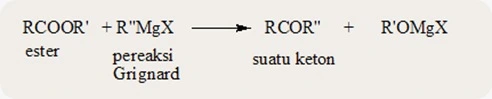
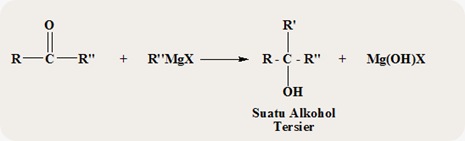
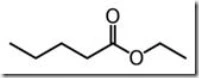
- TURUNAN ASAM KARBOKSILAT : ESTER
- Pasang jam di wordpress
- Contoh Soal dan Pembahasan berkaitan dengan Hukum Proust (Hukum Perbandingan Tetap)
- Ilmuwan Berhasil Membuat Air kering (Dry water)
- Langkah-langkah menulis persamaan reaksi dan penyetaraannya
- BEBERAPA OKSIDATOR DALAM LABORATORIUM (ION PERMANGANANAT, ION KROMAT DAN ION KROMAT)
- NITROGEN, ASAM NITRAT DAN PREPARASI NITROGEN DALAM LABORATORIUM
- Fulcanelli Ahli Kimia Misterius
- MP3 LAGU-LAGU TIMOR
- PENGARUH IKATAN HIDROGEN TERHADAP KELARUTAN DALAM AIR DAN TITIK DIDIH SUATU ZAT
- EBOOK GRATIS: CHEMISTRY 10th EDITION – RAYMOND CHANG
- ENERGI IKATAN, JARAK IKATAN DAN ENTALPI REAKSI
- STRUKTUR LEWIS SENYAWA IONIK
- Perbedaan Pati atau Amilum dengan Kanji atau Tepung
Top Posts
- STRUKTUR KRISTAL BEBERAPA SENYAWA IONIK
- 10 Dinosaurus Bertanduk Paling Spektakuler dan Menakjubkan
- Ringkasan, contoh soal dan pembahasan mengenai asam, basa dan larutan penyangga
- Ilmuwan Berhasil Membuat Air kering (Dry water)
- Pengertian Dasar Spektrofotometer Vis, UV, UV-Vis
- Contoh soal dan pembahasaan menentukan kadar unsur dalam senyawa
- PEREAKSI PEMBATAS DAN CARA MENENTUKANNYA
- Dong Yi = Han Hyo Joo
- Gelombang Ultrasonik: Cara Kelelawar Melewati Gelapnya Malam dan Menemukan Mangsa
- PEMBUATAN, PENGENCERAN DAN PENCAMPURAN LARUTAN
SAHABAT-SAHABATKU
- My Facebook
- wanibesak.wordpress.com
- UNIVERSITAS NEGERI MALANG
- Buku Sekolah Elektronik (BSE)
- Ebookee Free Download eBook
- Hi-Res Images of Chemical Elements
- GOOGLE Search Insights
- camplong chemistry
- Jejaring Kimia
- Log Guru Kimia Borneo
- Kimia Farmasi
- Kumunitas Kimia
- Badan Standar Nasional (BSN)
- Science News
- Science Kits, Classes, and Experiments
- Abaut.com chemistry
- Science Experiments
- Dr. Loren Williams, Professor
- Science Home Experiments Is Fun
- Practical Chemistry
- Chemistry Comes Alive
- Science For Kids Fun
- Guru Pembantu
- Kepustakaan Presiden-Presiden Republik Indonesia
- TruLLy With Me
- JunJunG-CreaTor
- Turn Back to God
- Adnanomatic
- BOOTER-CENTER
- Akimlinovsisas Blog
- Ageng"s Blog
- Bersabar Itu Indah
- Sebastian Dika official Website
- FIKRI SHARE
- Blognya Yohan
- Digital library - Perpustakaan Pusat Unikom - Knowledge Center
YaNg Lagi EkSiS

TeLaH DiBuKa
- 11.996.876 KaLi
Bergabung dengan 232 pelanggan lain