!!..Buku Elektronik..!!
download buku-buku semua pelajaran untuk SD, SMP, SMA dan SMK secara gratis, silakan kunjungi situs http://bse.kemdiknas.go.id
CaRiLah Di SiNi
Kategori
- * BUKU GR4TIS
- * SMA KELAS I
- * SMA KELAS II
- * SMA KELAS III
- Eksperimen Kimia
- Humor
- ikatan kimia
- JESUS CHRIST OF NASARET
- Karbon Dan Senyawaannya
- KIMIA
- Komputer Dan Internet
- Logam dan Beberapa Jenis Logam
- Redoks dan elektrokimia
- Soal Kimia dan Pembahasan
- spektroskopi
- Tahukah Anda…?
- Z PICTURE AND WALPAPER
AdA YaNg BaRu NiH
- Hand Out Hukum Faraday
- Jalan-Jalan di Bali
- CONTOH SOAL DAN PEMBAHASAN LAJU REAKSI
- Briket Kulit Durian
- KORUPSI : Peninggalan Nenek Moyang Penghias Media Masa
- TURUNAN ASAM KARBOKSILAT : ESTER
- Pasang jam di wordpress
- Contoh Soal dan Pembahasan berkaitan dengan Hukum Proust (Hukum Perbandingan Tetap)
- Ilmuwan Berhasil Membuat Air kering (Dry water)
- Langkah-langkah menulis persamaan reaksi dan penyetaraannya
- BEBERAPA OKSIDATOR DALAM LABORATORIUM (ION PERMANGANANAT, ION KROMAT DAN ION KROMAT)
- NITROGEN, ASAM NITRAT DAN PREPARASI NITROGEN DALAM LABORATORIUM
- Fulcanelli Ahli Kimia Misterius
- MP3 LAGU-LAGU TIMOR
- PENGARUH IKATAN HIDROGEN TERHADAP KELARUTAN DALAM AIR DAN TITIK DIDIH SUATU ZAT
- EBOOK GRATIS: CHEMISTRY 10th EDITION – RAYMOND CHANG
- ENERGI IKATAN, JARAK IKATAN DAN ENTALPI REAKSI
- STRUKTUR LEWIS SENYAWA IONIK
- Perbedaan Pati atau Amilum dengan Kanji atau Tepung
Top Posts
- Contoh soal dan pembahasaan menentukan kadar unsur dalam senyawa
- Contoh Soal dan Pembahasan berkaitan dengan Hukum Proust (Hukum Perbandingan Tetap)
- Ringkasan, contoh soal dan pembahasan mengenai asam, basa dan larutan penyangga
- STRUKTUR KRISTAL BEBERAPA SENYAWA IONIK
- 10 Dinosaurus Bertanduk Paling Spektakuler dan Menakjubkan
- PEMBUATAN, PENGENCERAN DAN PENCAMPURAN LARUTAN
- Pengertian Dasar Spektrofotometer Vis, UV, UV-Vis
- PEREAKSI PEMBATAS DAN CARA MENENTUKANNYA
- TUMBUHAN-TUMBUHAN BERACUN YANG MEMATIKAN
- tatanama alkana, alkena dan alkuna
SAHABAT-SAHABATKU
- My Facebook
- wanibesak.wordpress.com
- UNIVERSITAS NEGERI MALANG
- Buku Sekolah Elektronik (BSE)
- Ebookee Free Download eBook
- Hi-Res Images of Chemical Elements
- GOOGLE Search Insights
- camplong chemistry
- Jejaring Kimia
- Log Guru Kimia Borneo
- Kimia Farmasi
- Kumunitas Kimia
- Badan Standar Nasional (BSN)
- Science News
- Science Kits, Classes, and Experiments
- Abaut.com chemistry
- Science Experiments
- Dr. Loren Williams, Professor
- Science Home Experiments Is Fun
- Practical Chemistry
- Chemistry Comes Alive
- Science For Kids Fun
- Guru Pembantu
- Kepustakaan Presiden-Presiden Republik Indonesia
- TruLLy With Me
- JunJunG-CreaTor
- Turn Back to God
- Adnanomatic
- BOOTER-CENTER
- Akimlinovsisas Blog
- Ageng"s Blog
- Bersabar Itu Indah
- Sebastian Dika official Website
- FIKRI SHARE
- Blognya Yohan
- Digital library - Perpustakaan Pusat Unikom - Knowledge Center
YaNg Lagi EkSiS

TeLaH DiBuKa
- 11.999.487 KaLi
Bergabung dengan 232 pelanggan lain

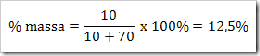


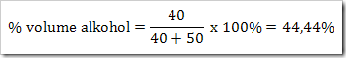



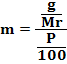
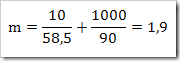
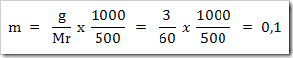




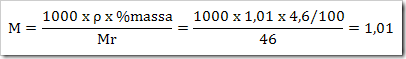


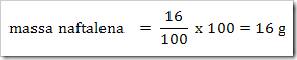
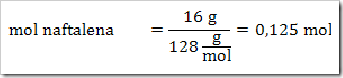
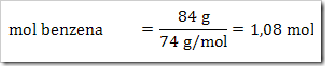
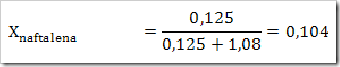
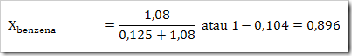
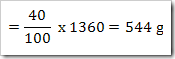
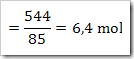
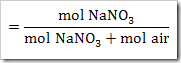

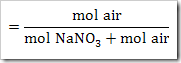

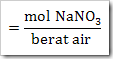
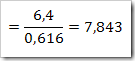

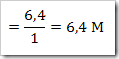



wah pengetahuan bertambah
Nambah rumus baru banget! 😀
T^hank you~
apakah larutan yang sangat encer (pelarut air) kemolalan dpat dianggap sama dengan kemolaran?
Apakah hal yang sama kemolalan dpat dianggap sama dengan kemolaran? (jika pelarutnya bukan air)?
Makasiih atas jawabannya
makasih infonya,,, terus berkarya yah:),,,,
sangat membantu aq bgt