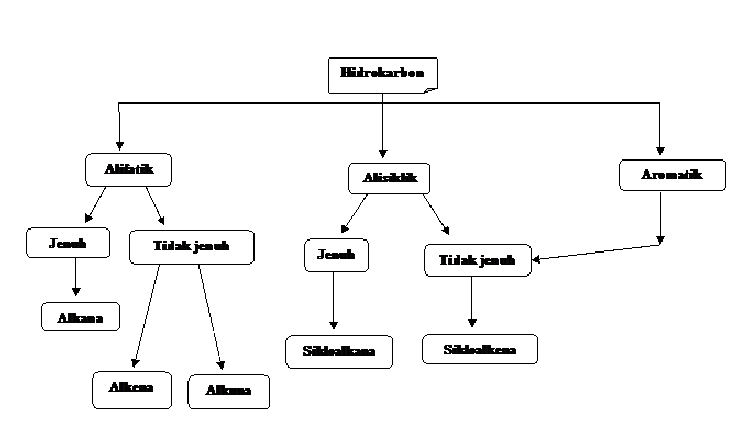
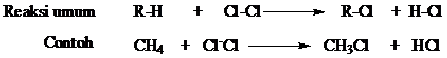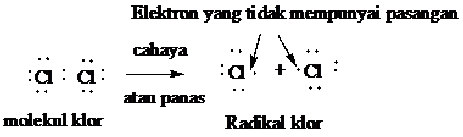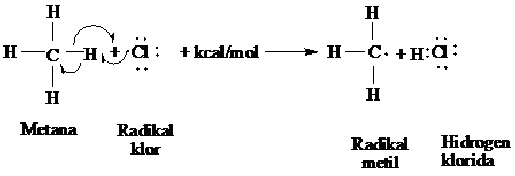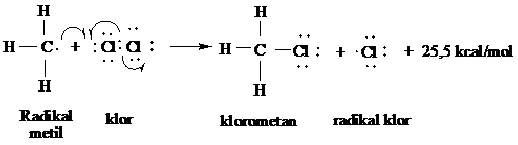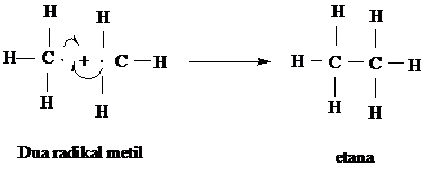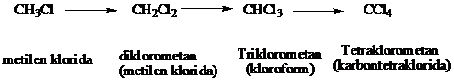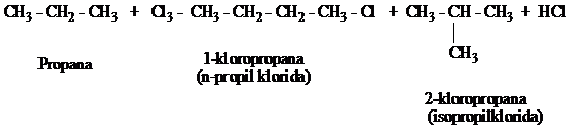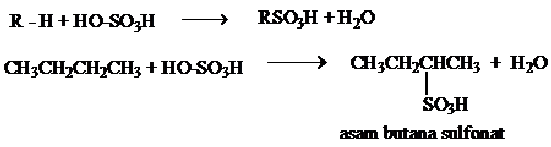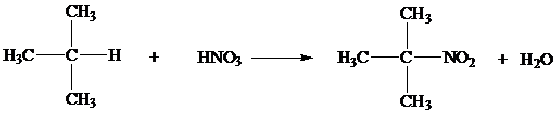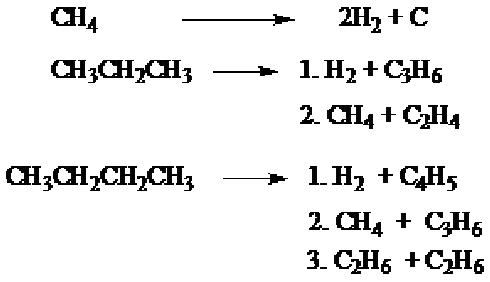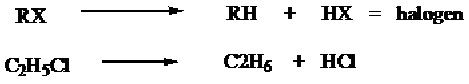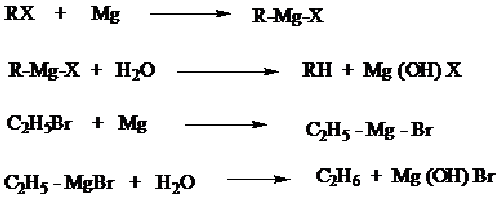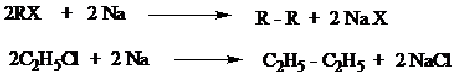Penggolongan hidrokarbon
Sifat Fisika
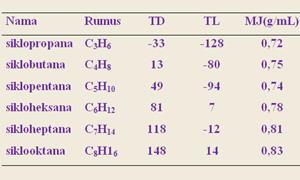
Alkana yang memiliki massa molekul rendah yaitu metana, etana, propana dan butana pada suhu kamar dan tekanan atmosfer berwujud gas, alkana yang memiliki 5-17 atom karbon berupa cairan tidak berwarna dan selebihnya berwujud padat.
Alkana merupakan senyawa nonpolar sehingga sukar larut dalam air tetapi cenderung larut pada pelarut-pelarut yang nonpolar seperti eter, CCl4. Jika alkana ditambahkan ke dalam air alkana akan berada pada lapisan atas, hal ini disebabkan adanya perbedaan massa jenis antara air dan alkana. Sebagian besar alkana memiliki massa jenis lebih kecil dari massa jenis air.
Karena alkana merupakan senyawa nonpolar, alkana yang berwujud cair pada suhu kamar merupakan pelarut yang baik untuk senyawa-senyawa kovalen. Beberapa sifat fisika alkana dapat dilihat pada Tabel.
|
Nama
|
Titik leleh (ºC)
|
Titik didih (ºC)
|
Massa jenis (g/cm3)
|
|
Metana
Etana
Propana
Butana
Pentana
Heksana
Heptana
Oktana
Nonana
Dekana
|
-182
-183
-188
-138
-130
-95
-91
-57
-51
-30
|
-162
-89
-42
0
36
69
98
126
151
174
|
0,423
0,545
0,501
0,573
0,526
0,655
0,684
0.703
0.718
0.730
|
Sifat Kimia Alkana
Reaksi-Reaksi Alkana
Seperti yang diektahui bahwa ikatan pada alkana berciri tunggal, kovalen dan nonpolar. Oleh karenanya alkana relatif stabil (tidak reaktif) terhadap kebanyakan asam, basa, pengoksidasi atau pereduksi yang dapat dengan mudah bereaksi dengan kelompok hidrokarbon lainnya. Karena sifatnya yang tidak reaktif tersebut, maka alkana dapat digunakan sebagai pelarut.
Walaupun alkana tergolong sebagai senyawaan yang stabil, namun pada kondisi dan pereaksi tertentu alkana dapat bereaksi dengan asam sulfat dan asam nitrat, sekalipun dalam temperatur kamar. Hal tersebut dimungkinkan karena senyawa kerosin dan gasoline mengandung banyak rantai cabang dan memiliki atom karbon tersier yang menjadi activator berlangsungnya reaksi tersebut. Berikut ini ditunjukkan beberapa reaksi alkana :
1. Oksidasi
Alkana sukar dioksidasi oleh oksidator lemah atau agak kuat seperti KMNO4, tetapi mudah dioksidasi oleh oksigen dari udara bila dibakar. Oksidasi yang cepat dengan oksingen yang akan mengeluarkan panas dan cahaya disebut pembakaran atau combustion
Hasil oksidasi sempurna dari alkana adalah gas karbon dioksida dan sejumlah air. Sebelum terbentuknya produk akhir oksidasi berupa CO2 dan H2 O, terlebih dahulu terbentuk alkohol, aldehid dan karboksilat.
Alkana terbakar dalam keadaan oksigen berlebihan dan reaksi ini menghasilkan sejumlah kalor (eksoterm)
CH4 + 2O2 → CO2 + 2H2 + 212,8 kkal/mol
C4H10 + 2O2 → CO2 + H2O + 688,0 kkal/mol
Reaksi pembakaran ini merupakan dasar penggunaan hidrokarbon sebagai penghasil kalor (gas alam dan minyak pemanas) dan tenaga (bensin), jika oksigen tidak mencukupi untuk berlangsungnya reaksi yang sempurna, maka pembakaran tidak sempurna terjadi. Dalam hal ini, karbon pada hidrokarbon teroksidasi hanya sampai pada tingkat karbon monoksida atau bahkan hanya sampai karbon saja.
2CH4 + 3O2 → 2CO + 4H2O
CH4 + O2 → C + 2H2O
Penumpukan karbon monoksida pada knalpot dan karbon pada piston mesin kendaraan bermotor adalah contoh dampak dari pembakaran yang tidak sempurna. Reaksi pembakaran tak sempurna kadang-kadang dilakukan, misalnya dalam pembuatan carbon black, misalnya jelaga untuk pewarna pada tinta.
2. Halogenasi
Reaksi dari alkana dengan unsur-unsur halogen disebut reaksi halogenasi. Reaksi ini akan menghasilkan senyawa alkil halida, dimana atom hidrogen dari alkana akan disubstitusi oleh halogen sehingga reaksi ini bisa disebut reaksi substitusi.
Halogenasi biasanya menggunakan klor dan brom sehingga disebut juga klorinasi dan brominasi. Halongen lain, fluor bereaksi secara eksplosif dengan senyawa organik sedangkan iodium tak cukup reaktif untuk dapat bereaksi dengan alkana.
Laju pergantian atom H sebagai berikut H3 > H2 > H1. Kereaktifan halogen dalam mensubtitusi H yakni fluorin > klorin > brom > iodin.
Reaksi antara alkana dengan fluorin menimbulkan ledakan (eksplosif) bahkan pada suhu dingin dan ruang gelap.

Jika campuran alkana dan gas klor disimpan pada suhu rendah dalam keadaan gelap, reaksi tidak berlangsung. Jika campuran tersebut dalam kondisi suhu tinggi atau di bawah sinar UV, maka akan terjadi reaksi yang eksoterm. Reaksi kimia dengan bantuan cahaya disebut reaksi fitokimia.
Dalam reaksi klorinasi, satu atau lebih bahkan semua atom hidrogen diganti oleh atom halogen. Contoh reaksi halogen dan klorinasi secara umum digambarkan sebagai berikut:
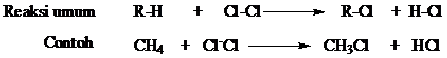
Untuk menjelaskan keadaan ini, kita harus membicarakan mekanisme reaksinya. Gambaran yang rinci bagaimana ikatan dipecah dan dibuat menjadi reaktan dan berubah menjadi hasil reaksi.
Langkah pertama dalam halogenasi adalah terbelahnya molekul halogen menjadi dua partikel netral yang dinamakan radikal bebas atau radikal. Suatu radikal adalah sebuah atom atau kumpulan atom yang mengandung satu atau lebih elektron yang tidak mempunyai pasangan. Radikal klor adalah atom yang klor yang netral, berarti atom klor yang tidak mempunyai muatan positif atau negatif.
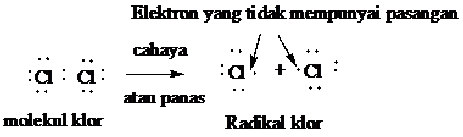
Pembelahan dari molekul Cl2 atau Br2 menjadi radikal memerlukan energi sebesar 58 Kcal/mol untuk Cl2 dan 46 kcal/mol untuk Br2. Energi yang didapat dari cahaya atau panas ini, diserap oleh halongen dan akan merupakan reaksi permulaan yang disebut langkah permulaan.
Tahap kedua langkah penggadaan dimana radikal klor bertumbukan dengan molekul metan, radikal ini akan memindahkan atom atom hidrongen (H ) kemudian menghasilkan H-Cl dan sebuah radikal baru, radikal metil ( CH3).
Langkah I dari siklus penggadaan
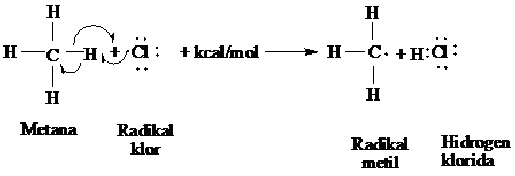
Radikal bebas metil sebaliknya dapat bertumbukan dengan molekul (Cl2) untuk membedakan atom khlor dalam langkah penggandaan lainnya.
Langkah 2 dari siklus penggadaan
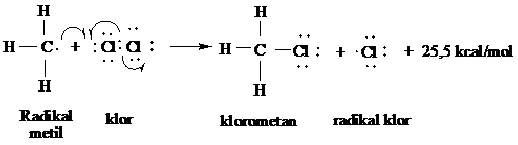
Langka ketiga Reaksi Penggabungan Akhir. Reaksi rantai radikal bebas berjalan terus sampai semua reaktan terpakai atau sampai radikalnya dimusnahkan. Reaksi dimana radikal dimusnahkan disebut langkah akhir. Langkah akhir akan memutuskan rantai dengan jalan mengambil sebuah radikal setelah rantai putus. Siklus penggandaan akan berhenti dan tak berbentuk lagi reaksi.
Suatu cara untuk memusnahkan radikal adalah dengan menggabungkan dua buah radikal untuk membentuk non radikal yang stabil dengan reaksi yang disebut reaksi penggabungan (coupling reaction). Reaksi penggabungan dapat terjadi bila dua buah radikal bertumbukan
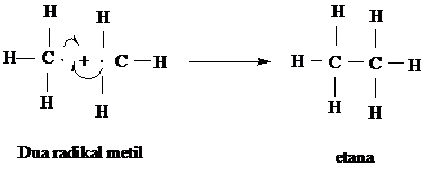
Radikal lainnya juga dapat bergabung untuk mengakhiri rangkaian reaksi tersebut. Misalnya CH3 dapat bergabung dengan Cl menghasilkan CH3Cl
Suatu masalah dengan radikal bebas adalah terbentuknya hasil campuran. Contohnya ketika reaksi khlorinasi metana berlangsung, konsentrasi dari metana akan berkurang sedangkan klorometan bertambah. Sehingga ada kemungkinan besar bahwa radikal klor akan bertumbukkan dengan molekul klormetan, bukannya dengan molekul metan.
Jika halogen berlebihan, reaksi berlanjut dan memberikan hasil-hasil yang mengandung banyak halogen berupa diklorometana, trikloroetana dan tetraklorometana
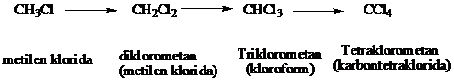
Keadaan reaksi dan perbandingan antara klor dan metana dapat diatur untuk mendapatkan hasil yang diinginkan.
Pada alkana rantai panjang, hasil reaksinya menjadi semakin rumit karena campuran dari hasil reaksi berupa isomer-isomer semakin banyak. Misalnya pada klorinasi propana
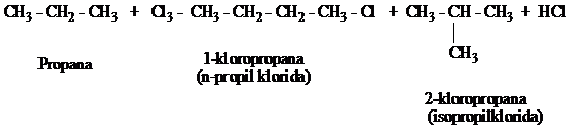
Bila alkana lebih tinggi dihalogenasi, campuran hasil reaksi menjadi rumit, pemurnian atau pemisahan dari isomer-isomer sulit dilakukan. Dengan demikian halogenasi tidak bermanfaat lagi dalam sintesis alkil halida. Akan tetapi pada sikloalkana tak bersubtitusi dimana semua atom hidrogennya setara, hasil murni dapat diperoleh. Karena sifatnya yang berulang terus reaksi semacam ini disebut reaksi rantai radikal bebas.
3. Sulfonasi Alkana
Sulfonasi merupakan reaksi antara suatu senyawa dengan asam sulfat. Reaksi antara alkana dengan asam sulfat berasap (oleum) menghasilkan asam alkana sulfonat. dalam reaksi terjadi pergantian satu atom H oleh gugus –SO3H. Laju reaksi sulfonasi H3 > H2 > H1.
Contoh
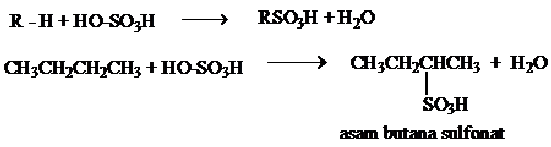
4. Nitrasi
Reaksi nitrasi analog dengan sulfonasi, berjalan dengan mudah jika terdapat karbon tertier, jika alkananya rantai lurus reaksinya sangat lambat.
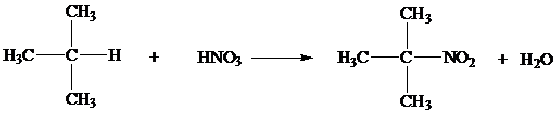
5. Pirolisis (Cracking)
Proses pirolisis atau cracking adalah proses pemecahan alkana dengan jalan pemanasan pada temperatur tinggi, sekitar 10000 C tanpa oksigen, akan dihasilkan alkana dengan rantai karbon lebih pendek
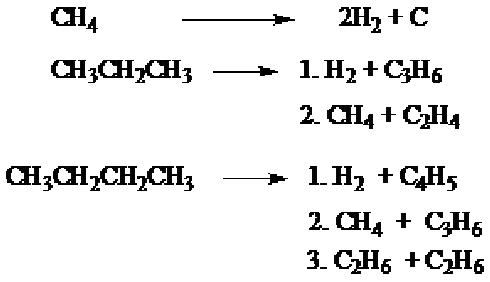
Proses pirolisis dari metana secara industri dipergunakan dalam pembuatan karbon-black. Proses pirolisa juga dipergunakan untuk memperbaiki struktur bahan bakar minyak, yaitu, berfungsi untuk menaikkan bilangan oktannya dan mendapatkan senyawa alkena yang dipergunakan sebagai pembuatan plastik. Cracking biasanya dilakukan pada tekanan tinggi dengan penambahan suatu katalis (tanah liat aluminium silikat).
Cara Pembuatan Alkana
Cara Khusus pembuatan metana
a. Metana dapat diperoleh dari pemanasan unsur-unsurnya pada temperatur 1200°C.
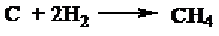
b. Metana dapat diperoleh secara tidak langsung, yaitu dari senyawa CS2, H2 S dan logam Cu, ini dikenal sebagai metoda Berthelot.

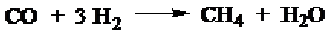
c. Metana dapat diperoleh dari monoksida dan hidrogen akan menghasilkan metana

d. Reduksi katalis dihasilkan dari pemanasan sodium asetat dengan basa kuat (KOH/NaOH) tanpa adanya air.
e. Metana dapat dihasilkan dari pemanasan sodium asetat dengan basa kuat (KOH/NaOH) tanpa adanya air. Pada reaksi ini biasanya ditambahkan soda lime (campuran NaOH) dan CaO) untuk mencegah tejadinya keausan tabung gelasnya.
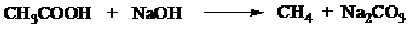
Cara Umum
a) Alkana dapat diperoleh dari reduksi alkil halida dan logam, misalnya logam Zn (campuran Zn + Cu) atau logam Na dan alcohol.
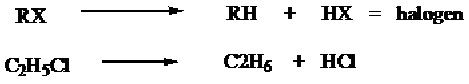
b) Alkana dapat diperoleh dari alkil halida melalui terbentuknya senyawa grignard kemudian dihidrolisis.
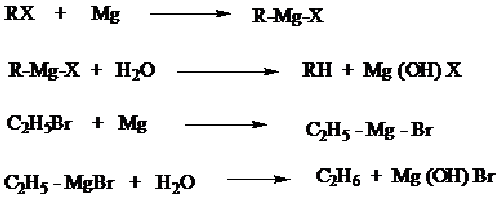
c) Alkana dapat diperoleh dari alkil halida oleh logan Na (reaksi Wurtz), dimana alkana yang dihasilkan mempunyai atom karbon dua kali banyak dari atom karbon alkil halida yang digunakan.
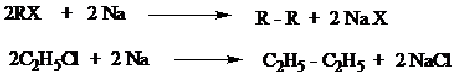
File Artikel ini silakan download di sini…!!!!!
Lihat Juga :
1. tatanama alkana, alkena dan alkuna
2. mengapa alkana bercabang memiliki titik didih lebih rendah
3. PEREAKSI PEMBATAS DAN CARA MENENTUKANNYA
4. Penyetaraan Reaksi Redoks