Alkohol merupakan suatu senyawa organik organik yang tersusun dari atom C, H dan O dengan rumus umum CnH2n+1OH. Ciri khas alkohol yaitu terdapatnya gugus –OH pada rantai karbon. Rantai karbon dapat berupa gugus alkil jenuh maupun tidak jenuh, gugus alkil tersubtitusi dan dapat pula terikat pada rantai siklik. Selain alkohol dengan satu gugus –OH dikenal pula alkohol yang memiliki gugus –OH lebih dari satu. Alkohol yang memiliki satu gugus –OH disebut alkohol monohodroksi, alkohol dengan dua gugus –OH disebut alkohol dihidroksi dan seterusnya.
Berdasarkan atom karbon yang mengikat gugs –OH alkohol dikelompokan menjadi:
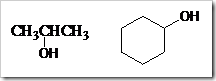
a. Alkohol primer, yaitu alkohol yang gugus –OH terikat pada C primer
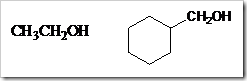
b. Alkohol sekunder, yairu alkohol yang gugus –OH terikat pada C sekunder
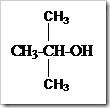
c. Alkohol tersier, yaitu alkohol yang gugus –OH terikat pada C tersier
Tata Nama Alkohol
Tata nama IUPAC
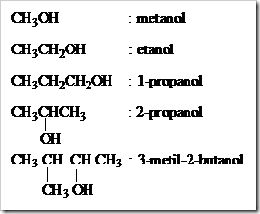
1) Tata nama alkohol tidak begitu berbeda dengan pemberian nama pada alkana. Perbedaannya yaitu akhiran –a pada alkana terkait diganti dengan akhiran –ol.
2) Pemberian nomor pada atom karbon dimulai dari atom karbon yang paling dekat dengan gugus –OH.
Contoh
Tata Nama Trivial
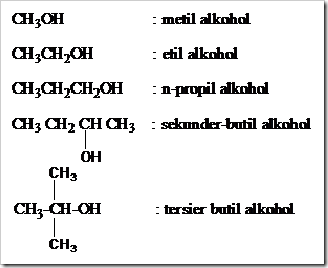
Tata nama trivial atau nama umum hanya berlaku untuk alkohol-alkohol suku rendah atau alkohol-alkohol dengan rumus molekul sederhana. Tata nama trivial untuk alkohol yaitu dengan menyebut nama gugus alkil yang mengikat gugus –OH kemudian diikuti dengan kata alkohol.
Isomer dan Sifat Alkohol
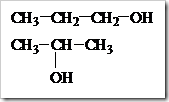
Senyawa-senyawa alkohol dengan jumlah atom karbon yang sama dapat mengalami isomer. Pada alkohol terjadi isomer posisi, yaitu alkohol dengan jumlah atom karbon sama tetapi letak gugus –OH dalam struktur berbeda. Misalnya alkohol dengan rumus molekul C3H8O dapat ditulis dengan dua rumus struktur
Kelarutan alkohol dalam air dipengaruhi oleh jumlah atom karbon yang terdapat pada alkohol. Alkohol dengan 1-3 atom karbon meruapakan cairan tak berwarna dan dapat larut dalam air dengan segala perbandingan, 4-5 atom karbon sedikit larut dalam air sedangkan alkohol dengan jumlah atom karbon > 6 tidak larut dalam air.
Berdasarkan struktur yang dimiliki, alkohol merupakan gabungan antara alkana atau gugus R dan air. Gugus R bersifat nonpolar atau lipofilik, gugus –OH bersifat polar atau hidrofobik, ketika alkohol dengan jumlah atom karbon sedikit ketika dilarutkan dalam air maka gugus –OH dapat membentuk ikatan hidrogen dengan molekul air. Namun ketika jumlah atom karbon makin banyak maka sifat nonpolar dari gugus R atau alkana lebih dominan sehingga kelarutan dalam air berkurang bahkan tidak larut ketika jumlah atom karbon makin banyak.
Makin tinggi berat molekul maka makin tinggi pula titik didih dan viskositasnya. Titik didih alkohol lebih tinggi dari alkana yang berat molekulnya hampir sama karena terbentuk ikatan hidrogen dengan sesama molekul alkohol. Pada alkana tidak terbentuk ikatan hidrogen antar sesama molekul.
Titik didih alkohol titik didh alkohol primer > alkohol sekunder > tersier. Pada alkohol-alkohol bercabang memiliki titik didih lebih rendah dari alkohol dengan dengan rantai lurus. Dengan ketentuan memiliki berat molekul yang hampir sama atau dengan jumlah atom karbon sama. Hal ini disebabkaa alkohol-alkohol bercabang bentuk molekulnya menyerupai bola.
Fungsi Alkohol
Berikut beberapa fungsi alkohol secara umum
a) Sebagai bahan dasar sintesis senyawa organik
b) Sebagai pelarut
c) Sebagai bahan dasar pembuatan deterjen sintetik misalnya lauril alkohol.
d) Sebagai bahan pembersih kaca
e) Untuk hewan-hewan koleksi yang berukuran kecil alkohol dapat dijadikan sebagai pengawet.
f) Campuran metanol dan etanol sering dicampurkan dengan bensin sebagai bahan bakar.
Reaksi-Reaksi pada Alkohol
Gugus –OH merupakan gugus fungsi dari alkohol oleh sebab itu sebagian besar reaksi terjadi pada gugus tersebut. Berikut merupakan beberapa reaksi yang terjadi pada alkohol: reaksi oksidasi, penggantian gugus –OH, penggantian atom H pada gugus –OH oleh gugus asam, logam aktif dan gugus alkil.
Oksidasi
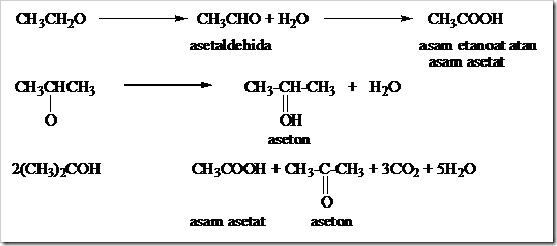
Alkohol dengan oksidator kuat seperti NA2Cr2O7 + H2SO4 dapat mengalami reaksi oksidasi. Hasil yang diperoleh dari reaksi oksidasi berbeda-beda tergantung pada jenis alkoholnya. Akohol primer jika teroksidasi menghasilkan aldehida apabila jumlah oksidator masih berlebih akan terjadi oksidasi berlanjut memebntuk asam karboksilat, alkohol sekunder menghasilkan keton sedangkan alkohol tersier menghasilkan campuran asam karboksilat dan keton. Reaksi antara alkohol primer, sekunder dan tersier dengan NA2Cr2O7 + H2SO4 dapat dilihat pada contoh.
Penggantian Gugus –OH
Gugus –OH pada alkohol dapat digantikan oleh atom-atom halogen apabila direaksikan dengan fosfor halida dan asam halida. Fosfor halida dapat berupa PX3 dan PX5 sedangkan asam halogen berupa HX.
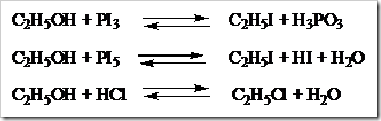
laju reaksi alkohol dengan asam halogen adalah alkohol tersier > alkohol sekunder > alkohol primer.
Penggantian Atom H pada Gugus –OH oleh Gugus Asam, Logam Aktif dan Gugus Alkil
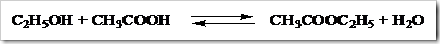
Reaksi diatas merupakan reaksi antara alkohol primer dan asam karboksilat. Bila dipanaskan dengan penambahan sedikit asam sulfat pekat maka akan terbentuk sebuah ester dan H2O. H2O yang diperoleh dari reaksi diatas dibentuk dari H dari alkohol dan OH dari asam asetat. Apabila digunakan alkohol tersier H diperoleh dari asam asetat dan OH dari alkohol.
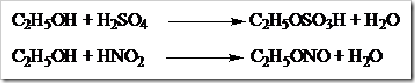
Apabila alkohol direaksikan dengan asam-asam anorganik produk yang diperoleh berupa ester anorganik. Produk yang diperoleh dari reaksi antara etanol dengan asam sulfat berupa etil hidrogen sulfat dan air, sedangkan produk yang diperoleh dari reaksi antara etanol dengan asam nitrit berupa etil nitrit dan air.
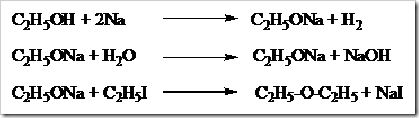
Atom H pada gugus –OH dapat digantikan oleh logam aktif seperti Na. Reaksi antara alkohol dan Na menghasilkan garam natrium alkoksida dan pembebasan gas hidrogen. Garam yang diperoleh dari reaksi ini apabila dihidrolisis akan diperoleh kembali alkohol asalnya. Laju pergantian atom H oleh logam aktif yaitu alkohol primer > alkohol sekunder > alkohol tersier.
Setelah pergantian atom H oleh logam aktif apabila direaksikan lagi dengan alkil halida akan terjadi pergantian logam aktif oleh gugus alkil. Logam aktif yang didesak keluar akan bereaksi dengan halogen dari alkil halida membentuk garam.
Beberapa Alkohol dalam Kehidupan Sehari-Hari
Metanol
Metanol atau metil alkohol merupakan suku pertama dari alkohol dengan rumus molekul CH3OH. Metanol bersifat toksit karena dapat menyebabkan kematian dan kebutaan apabila terkena mata. Metanol berupa zat cair tidak berwarna dengan titik didih 64.7 °C, massa jeni 0.7918 g/cm³,, mudah larut dalam air, mudah menguap dengan bau seperti alkohol biasa dan mudah terbakar. Spritus merupakan campuran antara metanol dan etanol. Warna pada etanol merupakan zat tambahan agar tidak diminum.
Matanol yang diproduksi sebagian besar digunakan sebagai bahan dasar pembuatan pembuatan formaldehit. Metanol sering dicampurkan dengan bensin, karena campuran ini diduga dapat meningkatkan mutu bensin. Namun demikian metanol yang ditambahkan memiliki kelemahan karena dapat menyebabkan korosi terhadap beberapa logam, termasuk aluminium. Berikut reaksi yang terjadi pada pembakaran metanol:

Metanol awalnya diperoleh dari penyulingan kering dari kayu. Kini metanol diperoleh dengan mereaksikan karbonmonoksida dengan hidrogen, dengan katalis ZnO + Cu. Campuran antara gas CO dan H2 dipanaskan dengan suhu sekitar 450 ºC dengan tekanan 200 atm.

Etanol
Etanol merupakan salah satu jenis alkohol yang dikonsumsi dan memiliki titik didih dan titik leleh berturut-turut 78 ºC dan 114 ºC. Etanol memiliki rumus molekul C2H5OH dan sering disingkat menjadi EtOH. Anggur, wiskey dan bir merupakan minuman keras yang mengandung etanol dengan konsentrasi tertentu. Etanol merupakan cairan yang jernih tidak berwarna, terasa membakar pada mulut maupun tenggorokan bila ditelan. Beberapa jenis minuman yang mengandung alkohol adalah sebagai berikut :
– Golongan A : kadar etanol 1% – 5% (bir)
– Golongan B : kadar etanol 5% – 20% (wine)
– Golongan C : kadar etanol 20% – 45% (whiskey, vodka, manson house, johny walker, kamput)
Minuman-minuman seperti anggur dan bir telah dikenal dikenal sejak zaman prasejarah. Pada zaman itu munuman-minuman tersebut diperoleh dari proses peragian atau fermentasi terhadap bahan-bahan yang mengandung pati atau gula. Bahan sebagai sumber pati dapat berupa kentang, ubi kayu dan beras. Umumnya bahan-bahan yang mengandung pati dapat diolah menjadi alkohol dengan proses peragian atau fermentasi. Awalnya bahan yang mengandung pati direndam dengan air sehingga terbentuk enzim amilase. Enzim amilase yang terbentuk secara bertahap menguraikan pati menjadi glukosa. Dengan bantuan enzim zimase yang terdapat di dalam ragi, glukosa yang terbentuk diuraikan menjadi etanol dan karbondioksida.
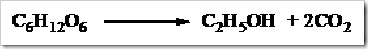
Proses fermentasi dilangsungkan pada suhu 25 ºC. Pada suhu rendah proses peragian berjalan lambat sedangkan pada suhu tinggi ragi yang ditambahkan akan terbunuh. Konsentrasi etanol yang diperoleh dari proses fermentasi maksimal 10-15%. Hal ini disebabkan pada konsentrasi lebih tinggi sel-sel ragi terbunuh sehingga proses penguraian glukosa terhenti.
Untuk meningkatkan kadar alkohol yang diperoleh dari proses fermentasi dilakukan dengan destilasi fraksional. Titik didih etanol 78 ºC dan titik didih air 100 ºC. Dari proses destilasi fraksional walaupun konsentrasi etanol sangat tinggi namun tidak diperoleh etanol absolut. Etanol absolut yaitu etanol dengan konsentrasi 100%. Hal ini disebabkan etanol dan air membentuk suatu campuran azeotropik sehingga hanya diperolehn etanol dengan kemurnian 96%. Campuran azeotropik yaitu campuran yang memiliki titik didih sama. Untuk memperoleh etanol absolut perlu dilakukan dengan cara kimia, yaitu dengan menambahkan CaO atau Mg(OCH3)2 sebagai penarik air.
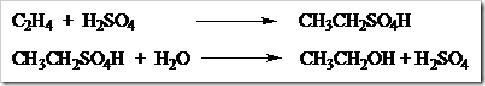
Selain dengan cara fermentasi etanol dapat pula diproduksi hidrasi etilena menggunakan katalis asam fosfat pada suhu 300 ºC.

Selain cara di atas dapat pula digunakan proses hidrasi secara tidak langsung etilena dengan H2SO4 pekat. Produk hidrasi yang diperoleh hidrolisis sehingga diperoleh etanol.
Alkohol Dihidroksi
Alkohol dihidroksi merupakan alkohol yang di dalam molekulnya terdapat 2 buah gugs –OH. Alkohol-alkohol yang memiliki dua buah gugus –OH disebut glikol. Salah satu contoh alkohol dihidroksi yaitu etilena glikol. Berikut rumus struktur etilena glikol: 
Etilena glikol merupakan cairan tidak berwarna yang memiliki rasa manis. Alkohol bersifat dan larut dengan baik di dalam air.
Alkohol Trihidroksi
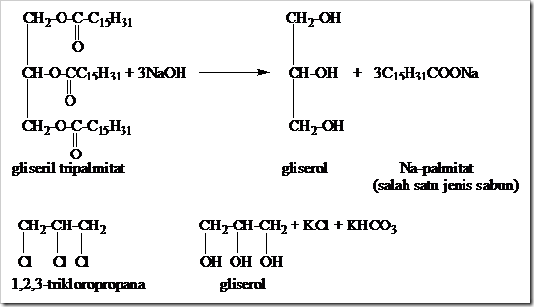
Alkohol trihidroksi merupakan alkohol yang didalam molekulnya terdapat 3 buah gugus –OH. Gliserol atau 1,2,3-propananatriol merupakan salah satu contoh terpenting dari alkohol trihidroksi. Istilah gliserol berasal dari bahasa Yunani glykys yang berarti manis. Gliserol pada temperatur kamar berupa cairan kental tidak berwarna yang memiliki rasa manis dengan titik didih dan titik leleh berturut-berturut 290 ºC dan 18 ºC, dapat bercampur dengan air dan alkohol pada segala perbandingan.
Gliserol di dalam laboratorium digunakan sebagai pelarut karena memiliki sifat penyerap air (higroskopis). Di dalam bidang industri gliserol digunakan sebagai bahan pembuat parfum, pelumas, dan digunakan sebagai bahan pembuat kosmetik karena gliserol mampu melembutkan kulit.
Gliserol umumnya dibuat dengan cara hidrolis lemak menggunakan NaOH dan hidrolisis 1,2,3-trikloropropana menggunakan K2CO3 dan H2O.