Senyawa Koordinasi
Seperti yang telah dijelaskan pada ikatan kovalen koordinasi NH3 dan BF3 bereaksi membentuk H3N.BF3. Secara umum senyawa yang terbentuk melalui ikatan kovalen koordinasi dianggap sebagai senyawa koordinasi atau senyawa kompleks. Lebih khusus lagi senyawa koordinasi adalah senyawa yang pembentukannya melibatkan pembentukan ikatan kovalen koordinasi antara ion logam atau logam dengan ion nonlogam. Kini senyawa-senyawa koordinasi yang dihasilkan dengan melibatkan pembentukan ikatan kovalen koordinasi lebih sering disebut sebagai senyawa kompleks.
Beberapa jenis senyawa kompleks, yaitu:
1. Senyawa kompleks netral. Misalnya [Ni(CO)4]
2. Senyawa kompleks ionik. Senyawa kompleks ionik terdiri atas ion positif (kation) dan ion negatif (anion) misalnya [Ag(NH3)2]. Dalam senyawa kompleks ionik salah satu dari ion tersebut atau keduanya dapat merupakan ion kompleks. 3 jenis senyawa kompleks ionik yaitu:
a. Senyawa kompleks ionik dengan kation sebagai ion kompleks.
b. Senyawa kompleks ionik dengan anion sebagai ion kompleks.
c. Senyawa kompleks ionik dengan kation dan anion sebagai ion kompleks.
Berikut adalah beberapa senyawa kompleks ionik
|
s.k.i kation sebagai ion kompleks
|
s.k.i anion sebagai ion kompleks
|
s.k.i kation dan anion sebagai ion kompleks
|
|
[Ag(NH3)2]Cl
[Co(NH3)6](NO3)3
|
K3[Fe(CN)6]
K2[PtCl4]
|
[Co(NH3)6] [Cr(Cn)]
[Pt(NH3)4] [PtCl4]
|
Keterangan s.k.i : senyawa kompleks ionik
Atom Pusat, Ligan dan Atom Donor
Pada pembentukan senyawa kompleks netral atau senyawa kompleks ionik, atom logam dan ion logam disebut sebagai atom pusat, sedangkan atom yang mendonorkan elektronnya ke atom pusat disebit atom donor. Atom donor dapat berupa suatu ion atau molekul netral. Ion atau molekul netral yang memiliki atom-atom donor yang dikoordinasikan pada atom pusat disebut ligan.
Pembentukan senyawa kompleks selalu ada molekul-molekul atau ion-ion yang mendonorkan elektronnya pada atom logam atau ionlogam. Elektron yang didonorkan biasanya berupa pasangan elektron (elektron pair) dari atom donor. Dari penjelasan-penjelasan tersebut atom donor yang terdapat pada ligan diartikan sebagai:
1) Atom yang memiliki pasangan elektron bebas. Misalnya NH3, H2O, CO, CN‾, NO2‾ dan Cl‾. Ligan-ligan ini merupakan basa Lewis yang dapat mendonorkan pasangan elektron bebasnya pada atom pusat yang berlaku sebagai asam Lewis.
![clip_image002[5] clip_image002[5]](https://wanibesak.files.wordpress.com/2010/10/clip_image0025_thumb.gif?w=260&h=88)
Gambar Struktur beberapa ligan yang memiliki pasangan elektron bebas
2) Atom yang memiliki elektron tak berpasangan. Misalnya C5H5 (siklopentadienil = Cp), C2H5 (alil) dan NO (nitrosil).
![clip_image004[4] clip_image004[4]](https://wanibesak.files.wordpress.com/2010/10/clip_image0044_thumb.gif?w=240&h=102)
Gambar Struktur ligan atom yang memiliki elektron tak berpasangan
3) Atom yang terikat melalui ikatan phi, π, (ikatan rangkap). Misalnya C2H2 (asetilena), C2H4 (etilena) dan C6H6 (benzena), struktur ketiga ligan berturut-turut dapat dilihat pada Gambar.
![clip_image006[4] clip_image006[4]](https://wanibesak.files.wordpress.com/2010/10/clip_image0064_thumb.gif?w=260&h=65)
Ligan yang memiliki ikatan phi (π) dan elektron tidak berpasangan merupakan donor elektron ganjil. Ligan alil mendonorkan 3 elektron.
Berdasarkan muatannya ligan, ligan dibagi menjadi tiga golongan, yaitu ligan netral, ligan bermuatan negatif dan ligan bermuatan positif. Pada umumnya ligan yang terdapat pada senyawa kompleks adalah ligan netral dan ligan negatif.
Berdasarkan banyaknya atom donor yang dimiliki ligan, ligan dapat dikelompokan menjadi:
1) Ligan monodentat
Ligan yang memiliki satu atom donor, contohnya NH3, H2O, CO dan Cl‾. Ligan monodentat yang atom donornya memiliki satu PEB biasanya hanya dapat membentuk sebuah ikatan kovalen koordinasi.
2) Ligan bidentat
Ligan yang memiliki dua atom donor, contohnya misalnya ion oksalat (COO‾COO‾) dan 1,2-diaminoetana (etilenadiamina) (NH2CH2CH2NH2).
Awalan mono, di dan tri menyatakan banyaknya atom donor yang terdapat pada ligan dan kata dentat berasal dari bahasa Latin dentatus yang berarti gigi.
Tata Nama Senyawa Kompleks
Tatanama senyawa kompleks terbagai menjadi dua jenis yakni tatanama sistematik dan tatanama umum.
Tata Nama Umum
Tatanama umum kini jarang bahkan tidak digunakan lagi. Hal ini disebabkan tatanama dengan cara ini hanya didasarkan atas nama penemu atau warna yang dimiliki senyawa koordinasi.
Berikut adalah beberapa contoh senyawa koordinasi yang penamaannya didasarkan atas nama penemunya:
|
Garam Vauquelin
|
:
|
[Pd(NH3)4] [PdCl4]
|
|
Garam Magnus
|
:
|
[Pt(NH3)4] [PtCl4]
|
|
Senyawa Gmelin
|
:
|
[Co(NH3)6]2(C2O4)3
|
|
Garam Zeise
|
:
|
K[PtCl3(C2H4)].H2O
|
Sedangkan nama senyawa koordinasi yang didasarkan atas warna yang dimiliki adalah:
|
Biru prusia (prusian blue)
|
:
|
KFe[Fe(CN)6].H2O
|
|
Kompleks luteo (kuning)
|
:
|
[Co(NH3)5Cl]Cl2
|
|
Kompleks praseo (hijau)
|
:
|
[Co(NH3)4Cl2]
|
Alasan-alasan nama umum jarang digunakan atau tidak digunakan:
1) Banyak senyawa kompleks yang berbeda namun disintesis oleh orang yang sama
2) Banyak senyawa kompleks yang berbeda namun memiliki warna yang sama.
Tata Nama Sistematik
Tata nama sistematik dibagi menjadi dua cara yakni
1) Tata nama yang didasarkan atas nama dan jumlah ligan yang ada serta nama atom pusat beserta tingkat oksidasinya. Bilangan oksidasinya ditulis di dalam tanda kurung menggunakan angka Romawi. Anggka Romawi yang diberikan disebut Angka Stock.
2) Tata nama yang didasarkan atas nama dan jumlah ligan, nama atom pusat serta muatan dari kompleks yang ada. Angka arab yang digunakan dapat berupa tanda positif atau negatif yang menunjukan muatan ion kompleks, angka Arab ini disebut angka Ewens-Bassett.
Tatanama Ligan
Tatanama Ligan netral
Tatanama ligan netral adalah seperti nama senyawanya kecuali untuk beberapa ligan seperti yang tertera pada Tabel.
|
Ligan
|
Nama senyawa
|
Nama ligan
|
|
MeCN
|
Asetonitril
|
Asetonitril
|
|
en
|
Etilenadiamina atau 1,2-diaminoetana
|
Etilenadiamina
|
|
py
|
Piridina
|
Piridina
|
|
AsPh3
|
trifenillarsina
|
trifenillarsina
|
|
phen
|
1,10-fenantrolina atau o-fenantrolina
|
1,10-fenantrolina
|
|
Perkecualian
|
|
|
|
H2O
|
Air
|
Aqua
|
|
NH3
|
Amonia
|
Amina atau azana
|
|
H2S
|
Hidrogen sulfida
|
Sulfan
|
|
H2Te
|
Hidrogen telurida
|
Telan
|
|
CO
|
Karbon monooksida
|
Karbonil
|
|
CS
|
Karbon monosulfida
|
Tiokarbonil
|
|
NO
|
Nitrogen monooksida
|
Nitrosil
|
|
NO2
|
Nitrogen monooksida
|
Nitril
|
|
NS
|
Nitrogen monosulfida
|
Tionitrosil
|
|
SO
|
Nitrogen monoksida
|
Sulfinil atau tionil
|
|
SO2
|
Belerang dioksida
|
Sulfonil atau sulfulir
|
Tatanama Ligan bermuatan negatif
Ligan negatif dapat berupa:
· Ion sisa asam. Ion sisa asam namanya dapat berakhiran –da, -it atau –at, misalnya klorida (Cl‾), nitrit (NO2‾) dan nitrat (NO3‾)
· Ion bukan sisa asam. Ion bukan sisa asam namanya biasanya berakhiran –da, misalnya nitrida (N3‾) dan ozonida.
Jika berlaku sebagai ligan baik ion sisa asam maupun ion bukan sisa asam yang berakhiran –da, diganti dengan akhiran –do, kecuali untuk beberapa ligan yang tertera pada Tabel.
|
Rumus kimia
|
Nama ion
|
Nama ligan
|
|
NH2
|
Amida
|
Amido
|
|
NH2‾
|
Imida
|
Imido
|
|
N3‾
|
Nitrida
|
Nitrido
|
|
N3‾
|
Azida
|
Azido
|
|
S2‾
|
Sulfida
|
Sulfido
|
|
O3‾
|
Ozonida
|
Ozonido
|
|
perkecualian
|
|
|
|
F‾
|
Fluorida
|
Fluoro
|
|
Cl‾
|
Klorida
|
Kloro
|
|
Br‾
|
Bromida
|
Bromo
|
|
I‾
|
Iodida
|
Iodo
|
|
O2‾
|
Oksida
|
Okso atau oksido
|
|
O22‾
|
Peroksida
|
Perokso
|
|
Te2‾
|
Telurida
|
Telurokso atau telurido
|
|
S2‾
|
Sulfida
|
Tio, tiokso atau sulfido
|
|
H‾
|
Hidrida
|
Hidro atau hidrido
|
|
SH‾
|
Hidrogen sulfida
|
Merkapto atau sulfanido
|
|
RO‾
|
Alkoksida
|
Alkoksi
|
|
C6H5O‾
|
Fenoksida
|
Fenoksi
|
|
CN‾
|
Sianida
|
Siano
|
Sedangkan untuk ion sisa asam yang berakhiran -it atau -at jika sebagai ligan akhirannya ditambah dengan akhiran –o, seperti yang tertera pada Tabel.
|
Rumus kimia
|
Nama ion
|
Nama ligan
|
|
ONO‾
|
Nitrit
|
Nitrito
|
|
NO2‾
|
Nitrit
|
Nitro
|
|
ONO2‾
|
Nitrat
|
Nitrato
|
|
OSO22‾
|
Sulfit
|
Sulfito
|
|
OSO32‾
|
Sulfat
|
Sulfato
|
|
OCN‾
|
Sianat
|
Sianato
|
|
SCN‾
|
Tiosianat
|
Tiosianato
|
|
CO32‾
|
Kabonat
|
Karbonato
|
Ligan bermuatan positif sangat jarang dijumpai pada senyawa kompleks oleh sebab itu tidak dibahas pada bagian ini. Salah satu ligan yang bermuatan positif adalah H2N-CH2-NH3+.
Dalam menulis ligan pada senyawa koordinasi biasanya atom donor selalu ditulis didepan, kecuali H2O, H2S dan H2Te. Misalnya untuk ion nitrit (NO2‾), jika N sebagai atom donor maka penulisan ligannya adalah NO2‾ sedangkan apabila O yang bertindak sebagai atom donor maka penulisan ligannya adalah ONO‾.
Urutan Penyebutan Ligan
1. Apabila di dalam senyawa kompleks terdapat lebih dari satu ligan maka urutan penyebutan ligan adalah secara alfabetis tanpa memperhatikan jumlah dan muatan ligan yang ada. Pada aturan lama ligan yang disebut terlebih dahulu adalah ligan yang bermuatan negatif secara alfabet kemudian diikuti dengan ligan netral yang disebut secara alfabet pula.
2. Urutan penyebutan ligan adalah urutan berdasarkan alfabet pada nama ligan yang telah di Indonesiakan. Misalnya alfabet awal untuk Cl‾ adalah k meskipun dalam bahasa inggris nama chloro dengan alfabet awal c. Sebagai contoh nama untuk senyawa kompleks [Co(en)2Cl2]+ adalah
Ion bis (etilenadiamina)diklorokobalt(III) (benar)
Diklorobis (etilenadiamina)kobalt(III) (salah)
3. Jumlah ligan yang ada dapat dinayatakan dengan awalan di, tri. Tetra dan seterusnya. tetapi apabila awalan-awalan tersebut telah digunakan untuk menyebut jumlah substituen yang ada pada ligan maka jumlah ligan yang ada dinyatakan dengan awalan bis, tris, tetrakis dan seterusnya. misalnya di dalam suatu senyawa kompleks terdapat dua ligan PPh3 maka disebut dengan bis(trifenilfosfina) bukan di(trifenilfosfina).
4. Ligan-ligan yang terdiri dari dua atom atau lebih ditulis dalam tanda kurung.
Tatanama Senyawa Kompleks Netral
1) Nama senyawa kompleks netral ditulis dalam satu kata.
2) Menulis atau menyebut nama dan jumlah ligan
3) Menulis atau menyebut nama atom pusat serta bilangan oksidasi dari atom pusatyang ditulis dengan anggka Romawi. Dan bilangan oksidasi atom pusat yang harganya nol tidak perlu dituliskan.
Contoh
|
[Co(NH3)3(NO2)3]
|
:
|
triaminatrinotrokobaltt(III)
|
|
[Ni(CO)4]
|
:
|
tetrakarbonilnikel
|
|
[Fe(CO)5]
|
:
|
pentakarbonilbesi
|
|
[Fe(CO)2(NO)2]
|
:
|
dikarbonildinitrosilbesi
|
|
[Co(CO)3(NO)]
|
:
|
trikarbonilnitrosilkobalt
|
Keterangan: triaminatrinotrokobaltt(III) merupakan kompleks dengan biloks = 0, selain itu merupakan kompleks dengan biloks 1.
Senyawa Kompleks Ionik
Senyawa kompleks ionik kation sebagai ion kopleks
penamaannya adalah sebagai berikut:
1) Diawali dengan menulis atau menyebut kata ion
2) Menulis atau menyebut nama dan jumlah ligan yang dimiliki
3) Menulis atau menyebut nama atom pusat diikuti bilangan oksidasi yang ditulis dalam anggka Romawi.
Selain cara di atas penamaan dapat dilakukan dengan cara berikut:
1) Diawali dengan menulis atau menyebut kata ion
2) Menulis atau menyebut nama dan jumlah ligan yang dimiliki
3) Menulis atau menyebut nama serta muatan dari ion kompleks yang ditulis dengan anggka Arab.
Contoh
|
Kompleks
|
Spesi yang ada
|
Nama
|
|
[Cu(NH3)4]2+
|
Cu2+ dan 4NH3
|
ion tetraaminatembaga(II), atau Ion tetraaminatembaga(2+)
|
|
[Co(NH3)4Cl2]+
|
Co3+, 4NH3, dan 2Cl‾
|
ion tetraaminadiklorokobalt(II) atau ion tetraaminadiklorokobalt(1+)
|
|
[Pt(NH3)4]2+
|
Pt2+, dan 4NH3
|
ion tetraaminaplatina(II) atau iontetraaminaplatina(2+)
|
|
[Ru(NH3)5(NO2)]+
|
Ru2+, 5NH3, dan NO2‾
|
ion pentaaminanitrorutenium(II) atau ion pentaaminanitrorutenium(1+)
|
Senyawa kompleks ionik anion sebagai ion kompleks
Penamaannya adalah sebagai berikut
1) Diawali dengan menulis atau menyebut kata ion
2) Menulis atau menyebut nama dan jumlah ligan yang dimiliki
3) Menulis atau menyebut nama atom pusat dalam bahasa latin dengan akhiran –um atau ium diganti –at kemudian diikuti bilangan oksidasi atom pusat yang ditulis dalam anggka Romawi.
Selain cara di atas penamaan dapat dilakukan dengan cara berikut
1) Diawali dengan menulis atau menyebut kata ion
2) Menulis atau menyebut nama dan jumlah ligan yang dimiliki
3) Menulis atau menyebut nama atom pusat dalam bahasa latin dengan akhiran –um atau ium diganti –at kemudian diikuti muatan dari ion kompleks yang ditulis dengan angka Arab.
Contoh
|
kompleks
|
Spesi yang ada
|
Nama
|
|
[PtCl4]2‾
|
Pt2+ dan 4Cl‾
|
Ion tetrakloroplatinat(I) atau ion tetrakloroplatinat(2-)
|
|
[Ni(CN)4]2‾
|
Ni2+ dan 4CN‾
|
Ion tetrasianonikelat(II) atau ion tetrasianonikelat(2-)
|
|
[Co(CN)6]3‾
|
Co3+ dan 6CN‾
|
Ion heksasianokobaltat(III) atau ion heksasianokobaltat(3-)
|
|
[CrF6]3‾
|
Cr3+ dan 6F‾
|
Ion heksafluorokromat(III) atau ion heksasianofluorokromat(3-)
|
|
[MgBr4]2‾
|
Mg2+ dan 4Br‾
|
Ion tetrabromomagnesat(II) atau Ion tetrabromomagnesat(2-)
|
Senyawa kompleks ionik kation dan anion sebagai ion kompleks
Penamaannya adalah menulis atau menyebut nama dan jumlah kation terlebih dahulu kemudian nama anion diikuti bilangan oksidasi atom pusat yang ditulis dalam anggka Romawi atau menulis atau menyebut nama dan jumlah kation terlebih dahulu kemudian nama anion diikuti muatan ion kompleks yang ditulis dengan angka Arab.
Contoh
|
K3[Fe(CN)6]3‾
|
:
|
Kalium heksasianoferat(III) atau kalium heksasianoferat(3-)
|
|
K4[Fe(CN)6]
|
:
|
Kalium heksasianoferat(II) atau kalium heksasianoferat(4-)
|
|
[CoN3(NH3)5]SO4
|
:
|
Pentaaminaazidokobalt(III) sulfat atau Pentaaminaazidokobalt(2+) sulfat
|
|
[Cu(NH3)4]SO4
|
:
|
Pentaaminatembaga(II) sulfat atau Pentaaminatembaga(2+) sulfat
|
|
[Cu(NH3)4] [PtCl4]
|
:
|
Tetraaminatembaga(II) tetrakloroplatinat(II) atau tetraamina tembaga(2+) tetrakloroplatinat(2-)
|
|
[Co(NH3)6] [Cr(CN)6]
|
:
|
Heksaaminakobalt(III) heksasianokromat(III) atau heksasianokobalt(3+) heksasianokromat(3-)
|
Apakah senyawa kompleks hanya dapat dibuat dari unsur transisi?
Pada awal perkembangan senyawa-senyawa kompleks atau senyawa koordinasi umumnya dibuat dari unsur-unsur transisi sebagai atom pusat. Disamping itu, senyawa yang dibentuk dari logam transisi selalu memiliki bilangan oksidasi atau tingkat oksidasi positif.
Namun kini senyawa kompleks atau senyawa koordinasi atom pusatnya tidak harus dari unsur transisi. logam alkali, alkali tanah dan logam utama lainnya dapat digunakan sebagai atom pusat untuk mensintesis senyawa komplek atau senyawa koordinasi. Misalnya NaCl yang dikonsumsi sehari-hari dalam kuah masakan merupakan suatu kompleks. NaCl di dalam air membentuk ion heksaaquanatrium(I), [Na(H2O)8]+. Ion tetrakloroaluminat(III) [AlCl]‾, Be(NO3)2.4H2O dan BeSO4.4H2O yang mengandung ion komplek tetraaquaberilium, [Be(H2O)4]2+, merupakan beberapa senyawa kompleks yang dibentuk dari unsur-unsur bukan unsur transisi.
Dari contoh-contoh diatas dapat disimpulkan bahwa senyawa kompleks, tidak hanya dibuat dengan unsur transisi sebagai atom pusat, tetapi dapat pula dibuat dengan unsur-unsur lain atau unsur-unsur logam golongan utama.
Apakah atom pusat suatu kompleks hanya memiliki bilangan oksidasi berharga positif?
Awalnya senyawa kompleks yang berhasil disintesis selalu memiliki bilangan oksidasi yang berharga positif. Berikut adalah beberapa contoh senyawa kompleks dengan bilangan oksidasi ion pusat berharga positif
|
Ion kompleks
|
Atom pusat
|
b.o atom pusat
|
|
[Co(NH3)6]3+
|
Co3+
|
+3
|
|
[Co(CN)6]3‾
|
Co3+
|
+3
|
|
[Cu(NH3)4]2+
|
Cu2+
|
+2
|
|
[Fe(CN)6]3‾
|
Fe3+
|
+3
|
|
[Pd(NH3)4]2+
|
Pd2+
|
+2
|
|
[PtCl4]2‾
|
Pt2+
|
+2
|
Keterangan: b.o = bilangan oksidasi
Dari contoh di atas dapat disimpulkan bahwa atom pusat suatu kompleks tidak harus memiliki bilangan oksidasi yang harganya positif. Atom pusat suatu kompleks dapat memiliki bilangan oksidasi nol dan negatif. Berikut adalah contoh kompleks dengan bilangan oksidasi nol dan harga bilangan oksidasi negatif.
|
kompleks
|
b.o atom pusat
|
Kompleks
|
b.o atom pusat
|
|
[V(CO)6]
|
0
|
[V(CO)6] ‾
|
-1
|
|
[Cr(CO)6]
|
0
|
[Cr(CO)5]2‾
|
-2
|
|
[Fe(CO)5]
|
0
|
[Mn(CO)5] ‾
|
-1
|
|
[Co(Cp)2]
|
0
|
[Fe(CO)4]2‾
|
-2
|
|
[Ni(CO)4]
|
0
|
[Re(CO)4]3‾
|
-3
|
Keterangan: b.o = bilangan oksidasi
Catatan: CO adalah ligan karbonil, Cp ligan siklopentadienil dan NO adalah ligan nitrosil. Ketiga ligan tersebut merupakan ligan netral.
Bilangan Koordinasi
Pada senyawa kompleks banyaknya atom yang terikat pada atom pusat disebut bilangan koordinasi. Bilangan koordinasi tidak sama dengan bilangan oksidasi atau tingkat oksidasi. Bilangan koordinasi biasanya 2 x bilangan oksidasi. Oleh sebab itu untuk unsur-unsur yang memiliki bilangan oksidasi lebih dari satu akan memeiliki bilangan koordinasi lebih dari satu, hal ini biasanya terjadi pada unsur-unsur transisi.
Untuk senyawa kompleks dengan ligan monodentat, bilangan koordinasi atom pusat adalah sama dengan jumlah ligan yang diikatnya. Bilangan koordinasi yang sering dijumpai pada senyawa kompleks adalah 4 dan 6.


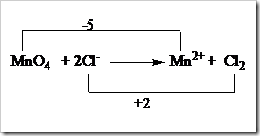
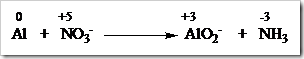
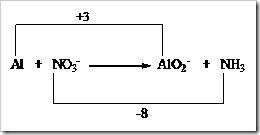
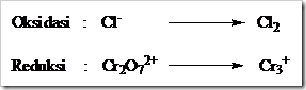



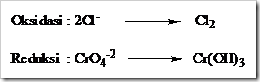
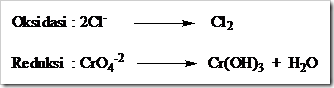








![clip_image002[5] clip_image002[5]](https://wanibesak.files.wordpress.com/2010/10/clip_image0025_thumb.gif?w=260&h=88)
![clip_image004[4] clip_image004[4]](https://wanibesak.files.wordpress.com/2010/10/clip_image0044_thumb.gif?w=240&h=102)
![clip_image006[4] clip_image006[4]](https://wanibesak.files.wordpress.com/2010/10/clip_image0064_thumb.gif?w=260&h=65)


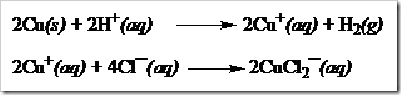
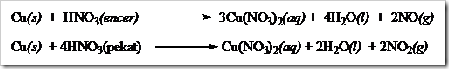




![clip_image002[5] clip_image002[5]](https://wanibesak.files.wordpress.com/2010/10/clip_image0025_thumb1.jpg?w=244&h=124)
![clip_image004[7] clip_image004[7]](https://wanibesak.files.wordpress.com/2010/10/clip_image0047_thumb1.gif?w=240&h=130)
![clip_image006[5] clip_image006[5]](https://wanibesak.files.wordpress.com/2010/10/clip_image0065_thumb1.jpg?w=244&h=125)
![clip_image008[4] clip_image008[4]](https://wanibesak.files.wordpress.com/2010/10/clip_image0084_thumb1.gif?w=244&h=129)
![clip_image010[4] clip_image010[4]](https://wanibesak.files.wordpress.com/2010/10/clip_image0104_thumb1.jpg?w=188&h=188)
![clip_image012[4] clip_image012[4]](https://wanibesak.files.wordpress.com/2010/10/clip_image0124_thumb1.jpg?w=202&h=202)
![clip_image014[4] clip_image014[4]](https://wanibesak.files.wordpress.com/2010/10/clip_image0144_thumb1.jpg?w=244&h=122)
![clip_image016[4] clip_image016[4]](https://wanibesak.files.wordpress.com/2010/10/clip_image0164_thumb1.jpg?w=244&h=197)
![clip_image018[4] clip_image018[4]](https://wanibesak.files.wordpress.com/2010/10/clip_image0184_thumb1.jpg?w=244&h=122)
![clip_image020[4] clip_image020[4]](https://wanibesak.files.wordpress.com/2010/10/clip_image0204_thumb1.jpg?w=173&h=172)


