Effendy
Jurusan Kimia, FMIPA Universitas Negeri Malang, Jl. Surabaya 6 Malang 65145
Siti Mutrofin
Jurusan Kimia, FMIPA Universitas Brawijaya, Jl. Veteran Malang 65145
Abstrak:
Pada pengajaran kimia unsur di sekolah menengah atas (SMA) disebutkan bahwa salah satu yang membedakan unsur-unsur logam transisi dengan logam alkali adalah dapatnya unsur-unsur logam transisi membentuk senyawa kompleks dan tidak dapatnya unsur-unsur logam alkali membentuk senyawa kompleks. Pendapat tersebut adalah tidak benar. Sebetulnya senyawa kompleks dari logam alkali telah berhasil dibuat sejak tahun 1840, yaitu dengan berhasil disintesisnya senyawa kompleks salisilaldehidatosalisilaldehidanatrium(I).
Sampai dengan tahun 1970 dapat dianggap sintesis senyawa kompleks dari logam alkali dilakukan secara tidak sistematis. Sintesis secara sistematik baru dilakukan mulai tahun 1985. Dari sintesis ini diperoleh banyak senyawa kompleks yang umumnya bersifat tidak stabil. Salah satu senyawa kompleks yang stabil adalah [K(phen)2(H2O)]2.4H2O.
Dapatnya senyawa kompleks dari logam alkali disintesis menyebabkan perlunya revisi pendapat di atas. Revisi pendapat tersebut merupakan tugas dari Himpunan Kimia Indonesia, khususnya para pakar dalam kimia koordinasi yang ada di himpunan tersebut.
Kata-kata kunci: Sintesis, senyawa kompleks, logam alkali, pengajaran senyawa kompleks di SMA.
Pendahuluan
Senyawa-senyawa kompleks sudah digunakan sejak sekitar 450 SM. Salah satunya adalah kompleks dari alizarin dengan ion aluminium dan kalsium. Senyawa kompleks ini dapat digunakan untuk memberi warna merah pada pakaian putih. Jubah nabi Yusuf kemungkinan diberi warna dari kompleks tersebut.
Pada waktu Iskandar Zulkarnaen dari Macedonia menyerbu Persia pakaian putih dari tentaranya disemprot dengan senyawa kompleks di atas dan mereka berjalan memasuki Persia seolah-olah sebagai pasukan yang lemah akibat luka-luka yang dideritanya. Tentara Persia tertipu sehingga akhirnya dapat dikalahkan oleh tentara Iskandar (Kauffman, 1987: 2).
Pada awal perkembangan sintesis senyawa kompleks, atom pusat yang umumnya digunakan adalah ion–ion logam transisi. Senyawa-senyawa kompleks dengan atom pusat ion logam golongan utama juga ada yang berhasil disintesis seperti senyawa kompleks salisilaldehidatosalisilaldehidanatrium(I) (Fenton, 1987: 2).

Gambar 1 Salisilaldehidatosalisilaldehidanatrium(I)
Diperolehnya fakta bahwa:
1) jumlah senyawa kompleks dengan atom pusat ion-ion logam golongan utama jumlahnya relatif sangat sedikit dibandingkan senyawa kompleks dengan atom pusat ion-ion logam transisi; dan
2) senyawa kompleks dengan atom pusat ion-ion logam golongan utama cenderung kurang stabil dibandingkan senyawa kompleks dengan atom pusat ion-ion logam transisi, tampaknya mengakibatkan timbulnya anggapan bahwa senyawa kompleks hanya dapat dibentuk dengan atom pusat ion-ion logam transisi saja.
Anggapan ini terbawa dalam pengajaran senyawa kompleks di SMA seperti teridentifikasi pada beberapa buku pelajaran kimia yang digunakan di SMA, misalnya pada buku: (1) Kimia SMU Kelas 3 Semester I dan II yang ditulis oleh Kalsum dkk. (2003: 157); (2) Pintar KIMIA 3 untuk SMU Kelas 3 yang ditulis oleh Sutresna (2003: 136).a
Ion-ion logam alkali memang cenderung sulit membentuk kompleks dengan ligan-ligan netral monodentat. Apabila kompleksnya dapat terbentuk, maka ia cenderung bersifat tidak stabil dan mudah terurai bila terjadi kontak dengan uap air dari udara.
Senyawa kompleks dari logam-logam alkali cenderung stabil apabila ligannya merupakan ligan polidentat yang membentuk sepit (chelate), seperti kompleks dengan ligan-ligan golongan eter mahkota (crown ether) (Greenwood & Earnshaw, 1986: 108). Di samping itu, apabila di dalam kristal senyawa kompleks terdapat molekul-molekul pelarut maka mereka cenderung mudah mengalami efloresensi atau desolvasi.a
Sintesis senyawa kompleks dari logam alkali dan alkali tanah
Sintesis senyawa kompleks dari logam-logam alkali biasanya dilakukan dalam kondisi bebas air dari pelarut atau dari udara. Untuk itu pelarut dan pereaksi yang digunakan harus dimurnikan lebih dulu. Sintesis biasanya dilakukan di dalam tabung Schlenk dan isolasi uap air dari udara dilakukan dengan menggunakan gas argon.
Kadang-kadang ada juga senyawa kompleks yang dapat disintesis dalam kondisi kontaks langsung dengan udara misalnya senyawa kompleks [K(phen)2(H2O)]2.4phen.4H2O (Mutrofin, Effendy dan White, 200).wanibesak
Pada masa lalu sintesis senyawa kompleks dari loam-logam alkali dan alkali tanah cenderung dilakukan secara tidak sistematis. Sintesis senyawa kompleks dari logam alkali baru dilakukan secara sistematis mulai tahun 1985 oleh C.R. Whitaker yang kemudian diteruskan oleh N. Placket, J. Buttery, S. Mutrofin dan Effendy.
Pada sintesis ini ligan-ligan yang digunakan adalah basa nitrogen seperti asetonitril (MeCN), piridina (py), kuinolina (quin) dan lain-lain. Dari hasil-hasil penelitian yang telah atau belum dipublikasikan diperoleh senyawa-senyawa kompleks dengan berbagai bilangan koordinasi dan struktur.a
Struktur senyawa kompleks dari logam-logam alkali
Senyawa kompleks dengan atom pusat ion-ion logam alkali dapat memiliki bilangan koordinasi 4, 5, 6, 7 dan 8. Bilangan koordinasi 4 banyak ditemukan untuk senyawa kompleks dengan ion pusat Li+. Hal ini disebabkan karena kecilnya ukuran ion Li+ (73-106 pm) yang cenderung sulit untuk mengikat lebih dari 4 atom donor. Bilangan koordinasi lebih besar dari 4 diperoleh pada senyawa kompleks dengan pusat ion Na+, K+, Rb+, atau Cs+.
1. Bilangan koordinasi 4
Senyawa kompleks dengan bilangan koordinasi 4 memiliki geometri tetrahedral terdistorsi. Contoh dari senyawa kompleks ini adalah [Li(MeCN)4]I (MeCN = asetonitril) (Raston dkk. 1989:987) yang merupakan kompleks ionik dan [LiI(quin)3] (quin = kuinolina) (Raston dkk. 1989:91) yang merupakan kompleks netral seperti ditunjukkan pada Gambar 2.
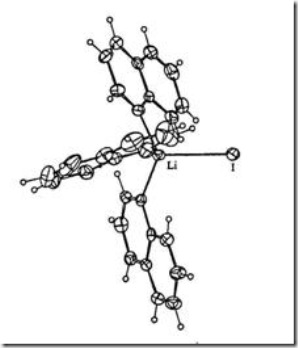
Gambar 2 Senyawa kompleks [LiI(quin)3]
2. Bilangan koordinasi 5
Contoh dari senyawa kompleks dari logam alkali dengan bilangan koordinasi 5 adalah tidak banyak. Salah satu diantaranya adalah [KI(dmp)2] (dmp = 2,9-dimetil-1,10-fenantrolina) (Mutrofin, Effendy dan White, 2000) yang berbentuk piramida alas bujur sangkar terdistrorsi seperti diberikan pada Gambar 3.

Gambar 3 Senyawa kompleks [KI(dmp)2]
3. Bilangan koordinasi 6
Senyawa kompleks dengan bilangan koordinasi 6 memiliki geometri oktehedral terdistorsi. Salah satu contohnya adalah polimer [KSO3CF3(phen)2]4 (phen = 1,10-fenantrolina) (Mutrofin, Effendy dan White, 2000) seperti diberikan pada Gambar 4.
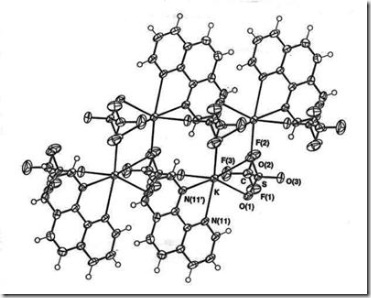
Gambar 4 Senyawa kompleks polimer [KSO3CF3(phen)2]4
4. Bilangan koordinasi 7
Senyawa kompleks dengan bilangan koordinasi 7 memiliki geometri trigonal prisma dengan satu tudung. Salah satu contohnya adalah kation dari kompleks polimer [K(phen)2]PF6 (Mutrofin, Effendy dan White, 2000) seperti diberikan pada Gambar 5.a
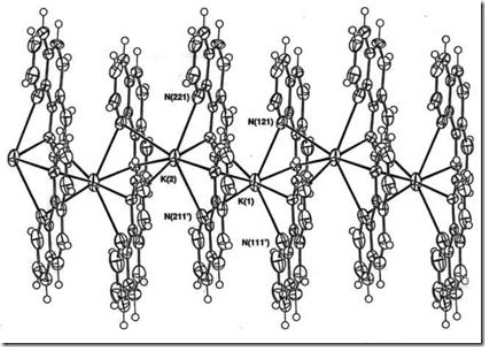
Gambar 5 Ion kompleks polimer [K(phen)2]
5. Bilangan koordinasi 8
Senyawa kompleks dengan bilangan koordinasi 8 memiliki geometri kubus teristorsi. Beberapa contohnya adalah [K(phen)2]I.MeOH dan [Rb(phen)2]I.MeOH, (Mutrofin, Effendy dan White, 2000). Struktur kation dari kompleks polimer [Rb(phen)2]I.MeOH diberikan pada Gambar 6.
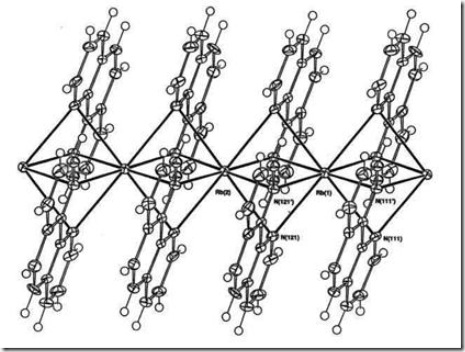
Gambar 6 Ion kompleks polimer [Rb(phen)2]![clip_image014[1] clip_image014[1]](https://wanibesak.files.wordpress.com/2011/06/clip_image0141_thumb.gif?w=11&h=24)
Di dalam senyawa kompleks dimungkinkan terdapat atom pusat dengan bilangan koordinasi yang berbeda, contohnya adalah pada kompleks [KSO3CF3)2(dmp)2(MeOH)]2 (Mutrofin, Effendy dan White, 2000) dengan struktur seperti pada Gambar 7.a
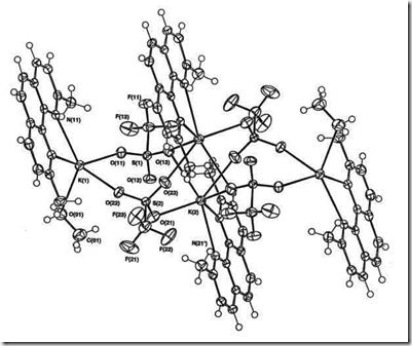
Gambar 7. Senyawa kompleks [KSO3CF3)2(dmp)2(MeOH)]2
Pada kompleks tersebut ion K(1)+ memiliki bilangan koordinasi 5, sedangkan ion K(2)+ memiliki bilangan koordinasi 6.
Di dalam sintesis senyawa kompleks dimungkinkan pelarut yang digunakan terkoordinasi pada ion pusat seperti ditunjukkan pada Gambar 7.. Apabila di dalam sintesis isolasi udara tidak sempurna atau sintesis dilakukan tanpa isolasi uap air dari udara, maka uap air dari udara dapat terkoordinasi pada atom pusat seperti yang terdapat pada kompleks [K(phen)2(H2O)]2.2ClO4.4H2O dengan struktur seperti pada Gambar 8.
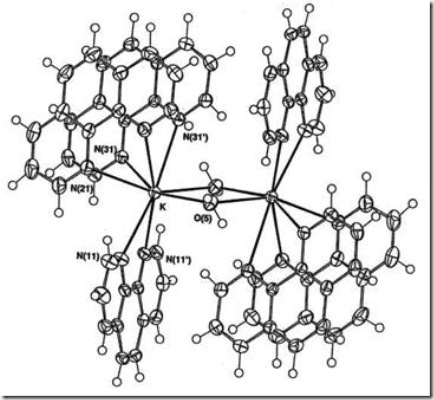
Gambar 8 Senyawa kompleks [K(phen)2(H2O)]2.2ClO4
Implikasi terhadap pengajaran kimia di SMA
Dengan berhasil disintesisnya senyawa kompleks dari logam-logam alkali maka anggapan bahwa senyawa kompleks hanya dapat dibentuk dari unsur-unsur transisi perlu direvisi.
Pada saat ini dapat dianggap hampir semua logam dapat membentuk senyawa kompleks. Revisi pendapat tersebut dapat dilakukan oleh Himpunan Kimia Indonesia, khususnya para pakar dalam kimia koordinasi yang ada di himpunan tersebut.
Untuk mengenal lebih jauh tentang penulis artikel ini silakan kunjungi “Daftar Guru Besar Universitas Negeri Malang” atau KLIK DI SINI…!!!!
FILE ASLI ARTIKEL INI SILAKAN DOWNLOAD DI SINI…!!!!
ARTIKEL YANG DISARANKAN :
· Tata Nama Senyawa Kompleks
· Apakah senyawa kompleks hanya dapat dibuat dari unsur transisi?
· senyawa kompleks‚ dan tatanama senyawa kompleks




















![Jesus-of-Nazareth[1] Jesus-of-Nazareth[1]](https://wanibesak.files.wordpress.com/2011/06/jesusofnazareth1_thumb.jpg?w=244&h=240)